Solutionnaire - Chapitre 5 Spectroscopie

Chapitre 5 – Solutionnaire © 2008 Les Éditions de la Chenelière inc.
1
Solutionnaire - Chapitre 5
Spectroscopie
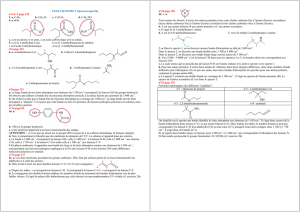
5.1 La molécule de hex-1-yne renferme une triple liaison alors que le hexa-1,3-diène
possède deux liaisons doubles.
hex-1-yne hexa-1,3-diène
En infrarouge, les bandes caractéristiques de ces deux groupements fonctionnels sont
différentes puisque les forces de ces liaisons ne sont pas les mêmes (revoir l’équation
5.4) : Alcyne : C≡C élongation (2260-2100 cm-1)
≡C-H élongation (3300-3260 cm-1)
Alcène : C=C élongation (1680-1620 cm-1)
=C-H élongation (3140-3020 cm-1)
5.2 a) À l’équation 5.4, il a été établie, selon la loi de Hooke, que plus la masse des
atomes est élevé, plus la bande caractéristique en infrarouge aura un nombre d’onde
faible. De ce fait, l’ordre croissant serait :
CH3Br < CH3Cl < CH3F
b) La loi de Hooke stipule que plus une liaison est forte, plus le nombre d’onde
caractéristique de la bande infrarouge sera élevée. Ainsi en jettent un regard attentif
aux structure développée, on constate :
HC
O
H
H
H
HC
O
HHC
O
OH
liaison simple
(plus faible que la
liason double)
liaison double
(plus forte que la
liason simple)
HC
O
OH
_
+
ou encore
HC
O
OH
δ+
δ_
Ca
r
acté
r
istique de la liaison C-O:
Hybride entre la liason
simple et la liaison double
Ainsi, le lien C-O de la molécule CH3OH possèdera la bande avec le plus petit nombre
d’onde puisque la liaison simple est une liaison plus faible qu’une liaison double.
Les liens C-O de la molécule HCO2H, quant à eux auront la deuxième bande
possédant le plus petit nombre d’onde puisque la liaison C-O n’est ni une double ni
une simple liaison grâce à la résonance possible de ce groupement fonctionnel.
La liaison de la molécule CH2O aura le plus grand déplacement en nombre d’onde
puisque la liaison est véritablement une liaison double (la séparation de charge est
possible mais désavantageuse puisqu’il y a alors violation de la règle de l’octet sur le
carbone!).

Chapitre 5 – Solutionnaire © 2008 Les Éditions de la Chenelière inc.
2
c) La molécule possédant une bande ayant le plus petit nombre d’ondes est la molécule
portant un carbanion. Cela s’explique par le fait qu’une résonance interne stabilise la
molécule en formant un hybride de résonance diminuent, par le fait même, le caractère de
la double liaison (analogue à la résonance présentée en b).
La bande de la molécule de propanone sera plus élevée en nombre d’ondes que celle
présentée ci-dessus puisque la fonction C=O ne subit pas de résonance. La fonction
carbonyle porte donc une liaison pi permanente.
Pour sa part, la molécule trichlorée aura une bande C=O dont le nombre d’ondes sera
le plus élevé. Cela s’explique par le fait que l’effet inductif attractif créé par les chlores
déstabilise la molécule advenant une séparation de charge du carbonyle. Ainsi, la liaison
C=O se voit plus difficile à briser et donc plus forte.
H3CCCH3
O
H3CCCCl3
O
Effet in
d
uctif att
r
actif
H3CCCH3
O
H3CCCCl3
O
δ+
δ+
δ
-
δ-
Effet in
d
uctif att
r
actif
Rupture défavorable puisque
le carbocation est déstabilisé
encore davantage par l'effet
inductif attractif des chlores
5.3 a) Bandes d’élongation caractéristiques des liaisons présentes dans la molécule :
C-H alcyne (3300-3260 cm-1)
C≡C alcyne (2260-2100 cm-1)
C-H alcane (3000-2850 cm-1)
C-N amine (1350-1000 cm-1)
N-H amine (3500-3300 cm-1)
b) Bandes d’élongation caractéristiques des liaisons présentes dans la molécule :
C-H aromatique (3100-3000 cm-1)
C=C aromatique (1600-1450 cm-1)
NO2 nitro (1560-1515 cm-1)
C-H aldéhyde (2900 cm-1 et 2700 cm-1)
C=O aldéhyde (1740-1720 cm-1).
c) Bandes d’élongation caractéristiques des liaisons présentes dans la molécule :
C-H alcanes (3000-2850 cm-1)
C=O cétone (1725-1705 cm-1)
C=O amide (1690-1650 cm-1)
N-H amide (3500-3350 cm-1)
d) Bandes d’élongation caractéristiques des liaisons présentes dans la molécule :
C-H alcane (3000-2850 cm-1)
C-H aromatique (3100-3000 cm-1)
C=C aromatique (1600-1450 cm-1)
C=O acide (1725-1700 cm-1)
O-H acide (3300-2500 cm-1)
C=O ester (1750-1735 cm-1)
C-O ester (1300-1000 cm-1)

Chapitre 5 – Solutionnaire © 2008 Les Éditions de la Chenelière inc.
3
Exercices supplémentaires
5.4 La formule moléculaire est C3H6O. Cette structure renferme une insaturation ou cycle.
L’absence d’une bande à 3500 cm-1 indique que le composé ne possède pas de
groupement hydroxyle, de liaison O-H. L’absence d’une bande vers 1720 cm-1 indique
que le composé ne renferme pas de fonction aldéhyde ou cétone. Il ne peut pas non
plus renfermer une fonction acide, n’ayant pas deux atomes d’oxygène. Ceci suggère
que l’atome d’oxygène fait partie d’une fonction éther. Les structures possibles sont
alors :
H3C O CH CH2
CH2
CH2CH2
O
CH2CH
O
CH3
III III
Enrichissement : Un spectre RMN 1H permettrait aisément de choisir la bonne
structure parmi ces possibilités. Par exemple, le composé I présenterait, entre autres,
un singulet avec un déplacement chimique d’environ 3 ou 4 ppm pour le groupement
méthyle. Le composé II aurait un triplet avec un déplacement chimique aux alentours
de 3 ou 4 ppm et une intégration de 4H. Enfin, le composé III donnerait un doublet
dans la région de 1 ou 1,5 ppm pour le groupement méthyle.
5.5 Plus les vibrations d’élongation des liaisons s’effectuent facilement, plus celles-ci
possèdent de petits nombres d’onde.
CH C
H
CH
3000-2850 cm-1 3140-3020 cm-1 3300 cm-1
C(sp3)-H C(sp2)-H C(sp)-H
Cela s’explique par le fait que les liaisons plus longues sont plus faibles (fragiles) et
vibrent donc plus facilement. Cette longueur et cette force de liaison sont une
conséquence de l’hybridation des atomes de carbone. La liaison C-H d’un alcane est
plus faible et plus longue et vibre donc plus facilement ; le nombre d’onde de la bande
d’absorption IR est alors plus petit que pour les liaisons C-H d’un alcène et d’un
alcyne.
5.6 Les données spectrales démontrent que la molécule d’éthanol CH3CH2OH possède bel
et bien un groupement fonctionnel alcool et que ce dernier peut participer à la
formation de ponts hydrogène. En effet, dans une solution diluée, les molécules
d’éthanol sont isolées et sont entourées par les molécules de solvant inerte, tel que le
CCl4. La fonction alcool de la molécule d’éthanol ne peut pas faire de ponts
hydrogène. La bande étroite d’absorption à 3580 cm-1 est causée par une fréquence
d’élongation d’une liaison O-H isolée. Cependant, au fur et à mesure que la solution

Chapitre 5 – Solutionnaire © 2008 Les Éditions de la Chenelière inc.
4
devient de plus en plus concentrée, les molécules d’éthanol peuvent former des ponts
hydrogène entre elles, pour ainsi offrir une bande large d’absorption de la liaison O-H
entre 3250 et 3350 cm-1. La diminution du nombre d’onde de la bande et son
élargissement sont causés par un affaiblissement de la liaison O-H due à la formation
des ponts hydrogène.
5.7 a) pentan-3-one
b) acide hexanoïque
c) pentan-1-ol
d) cyclohexane
Pour le pentan-3-one, remarquez la bande d’élongation caractéristique des cétones à
1715 cm-1. Pour l’acide hexanoïque, on retrouve à la fois la bande d’élongation de la
liaison C=O à 1710 cm-1, mais également la large bande d’élongation O-H
caractéristique des acides dans la région de 3300 – 2500 cm-1.
Le pentan-1-ol présente la bande d’élongation large caractéristique des alcools
(solution concentrée, présence de ponts hydrogène) à 3500 cm-1.
Finalement, le cyclohexane ne démontre aucun groupement fonctionnel, mais tout
simplement plusieurs bandes d’élongation des liaisons C-H des alcanes entre 3000 et
2850 cm-1.
5.8 Puisqu’un spectre infrarouge ne met en évidence que les groupements fonctionnels des
structures chimiques, les deux spectres seront très semblables. En effet, une bande
d’élongation caractéristique de la liaison C=C des alcènes (entre 1680 et 1620 cm-1) et
une bande d’élongation caractéristique de la liaison O-H des alcools (entre 3200-3650
cm-1) devraient être présentes. Rappelons toutefois que les deux spectres ne seront pas
identiques dans la région de l’empreinte digitale (entre 700 et 1500 cm-1), région
distincte pour chaque composé.
5.9 a) La première structure (à gauche) présente une cétone qui devrait montrer une bande
d’élongation typique de la liaison C=O entre 1725 et 1705 cm-1, alors que la deuxième
structure (à droite) renferme une fonction alcool (bande d’élongation de la liaison O-H
de 3650-3200 cm-1) et une fonction alcène (bande d’élongation de la liaison C=C de
1680-1620 cm-1).

Chapitre 5 – Solutionnaire © 2008 Les Éditions de la Chenelière inc.
5
b) Ces deux composés auront des similitudes spectrales puisqu’ils possèdent tous deux
la fonction aromatique (bandes d’élongation caractéristiques des liaisons C=C et C-H
aromatiques). Certaines différences seront néanmoins faciles à distinguer. En effet, la
première structure (à gauche) présente une fonction aldéhyde qui devrait offrir une
bande d’élongation caractéristique de la liaison C=O entre 1740 et 1720 cm-1 alors que
la deuxième structure (à droite) présente une fonction alcène (bande d’élongation C=C
entre 1680 et 1620 cm-1) et une fonction éther (bande d’élongation caractéristique C-O
entre 1300 et 1000 cm-1).
c) Puisqu’une amine tertiaire ne présente pas de lien N-H, il sera facile de distinguer
l’amine secondaire de celle tertiaire par la seule présence de la bande d’élongation
caractéristique de la liaison N-H entre 3500 et 3300 cm-1.
5.10 La prise d’un spectre infrarouge donnera instantanément l’information à savoir si le
substrat, l’octan-1-ol, a été complètement consommé (par la disparition complète de la
bande d’élongation caractéristique du groupement hydroxyle de la fonction alcool, la
liaison O-H) et si le produit attendu, l’octanal, a été obtenu (par l’apparition de la
bande spectrale caractéristique de la fonction aldéhyde, la liaison C=O). La
spectroscopie IR permettra de suivre la progression de la réaction et de déterminer la
pureté du produit final.
1
/
5
100%