Exemple de travail

Résumés vidéos – Cours inversé
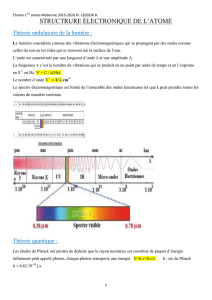
Vidéo 1 :
Après avoir synthétisé les molécules, il faut les analyser. On utilise donc ce que l’on
appelle une spectroscopie Infrarouge. Le principe est le suivant : on envoie une
radiation électromagnétique infrarouge. La longueur d’onde est donc plus élevée que
pour le visible, l’énergie est donc plus faible. L’intensité émise est I0, on mesure donc
l’intensité I en sortie.
Pour réaliser l’analyse, l’appareil utilisé est un spectrophotomètre à double
faisceaux. Il faut d’abord envoyer l’onde électromagnétique sur un solvant, puis
ensuite sur l’échantillon à analyser.
Pour obtenir le spectre d’absorption, on soustrait le spectre du solvant à celui de
l’échantillon. Pour faire l’analyse, les cuves doivent être transparentes aux
infrarouges (il ne faut donc pas une cuve en verre). Le solvant doit être anhydre. Par
exemple on choisira du tétrachlorure de carbone (CCL4).
En spectroscopie infrarouge, on travaille avec la transmitance. Elle correspond au
rapport de l’intensité entrante sur l’intensité sortante, notée T.
En spectroscopie infrarouge on n’utilisera pas la longueur d’onde mais plutôt le
nombre d’onde (noté σ).
σ= 1/λ
Le spectre infrarouge se décompose en deux axes : Transmitance (%) en fonction du
nombre d’ondes (en cm-1). Il y a sur ce graphique une particularité : l’axe des
abscisses est gradué de droite à gauche.
L’énergie des vibrations électromagnétiques va être convertie en énergie de
vibration. Chaque liaison de la molécule va osciller de plus en plus fortement et va
entrer en résonance pour une fréquence qui lui sera propre. Chaque liaison vibre
donc à une fréquence précise.
Il existe deux types de vibrations moléculaires, mais en Terminale nous nous
limiterons à l’étude des vibrations d’élongation : variation de la distance entre 2
atomes. Chaque vibration se traduit sur le spectre par différentes bandes
d’absorption. Chaque bande sur le spectre sera d’autant plus marquée que la liaison
sera polarisée.
Le spectre infra rouge est divisé en deux parties:
- si σ < 1400 cm-1: empreinte digitale de la molécule qui regroupe toutes les liaisons
C--C
- si σ < 1400 cm-1: partie où l'on peut analyser les différents groupes caractéristiques.
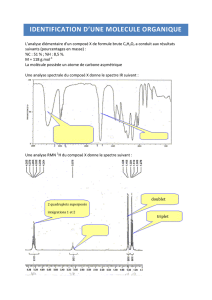
La spectroscopie infrarouge est donc principalement utilisée pour déterminer les
groupes fonctionnels d’une molécule.
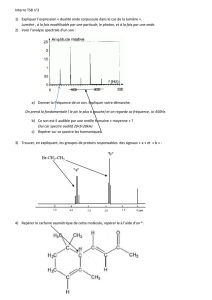
Vidéo 2 :
Pour faire l’analyse d’un spectre infrarouge, on procède en trois étapes :

- Dans un premier temps, il faut regarder la zone correspondant à σ=1700 cm-1. Cela
correspond au groupe carbonyle C=O. Dans le cas du spectre de l’aspirine, on peut
voir deux pics très intenses correspondant au groupe carbonyle.
On constate que le premier pic à 1700 cm-1 correspond à un groupe C=O. En
regardant dans un tableau permettant d’identifier les pics, on constate que ce groupe
C=O correspond à un acide carboxylique.
De plus, le deuxième pic correspondant au groupe C=O se situe environ à 1740 cm-1.
Il s’agit donc de l’ester. On peut selon ce même principe détecter la présence d’un
groupe aldéhyde ou encore d’un groupe cétone.
Pour pouvoir distinguer s’il s’agit d’une cétone, d’un ester … il faut trouver la
présence d’autres bandes caractéristiques.
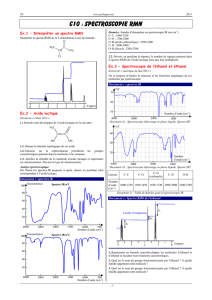
⁃ Dans un deuxième temps, il faut étudier le spectre aux alentours de 3000/3500
cm-1 pour détecter la présence d’un groupe hydroxyle. On remarque que c’est le cas
pour la molécule d’aspirine. Il y a une bande large correspondant à des groupes OH
liés. Cela signifie que ces groupes correspondent à des molécules en grosse
concentration liées entre elles par des liaisons hydrogènes. Ces liaisons provoquent
une diminution du nombre d’ondes, la bande se décale donc légèrement vers la
gauche et s’élargit. A l’inverse, si l’on obtient une solution d’alcool très diluée ou à
l’état gazeux, on obtient ce que l’on appelle des groupes OH libres. Il n’y a donc
aucune liaison hydrogène. Pour justifier que la molécule contient la fonction ester, on
constate dans la zone de l’empreinte digitale une bande intense, aux environs de
1200 cm-1 correspondant à la liaison simple C-O présente dans les esters.
⁃ Enfin, si nous ne notifions pas la présence de groupe CO ou groupe hydroxyle,
il nous reste à justifier la présence d’une liaison CH. Pour les alcanes, la bande se
situe entre 2850 et 2950 cm-1, entre 3050 et 3080 cm-1 pour les alcènes et entre 3020
et 3050 cm-1 pour les groupes aromatiques. De plus, pour repérer un alcène, il faut
détecter la présence d’une bande aux environ de 1640 cm-1 correspondant à une
liaison C=C. Pour un groupe aromatique, il faut repérer une liaison C=C aux environs
de 1450 cm-1.
Finalement, on en conclue que l’analyse d’une spectroscopie infrarouge permet de
détecter la présence de certains groupes fonctionnels, donc de certaines liaisons dans
une molécule.
Très bon résumé. Tu a repris l'essentiel des idées principales du cours.
1
/
2
100%