énoncé - Chimie PC La Martinière Monplaisir

PC 2016 – 2017 Lycée La Martinière Monplaisir
ORGA2 – Addition nucléophile suivie d'élimination TD n°10 – 1 / 2
TD n°10
ORGA2 – ADDITION NUCLÉOPHILE SUIVIE D'ÉLIMINATION
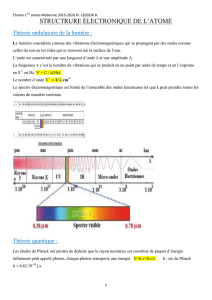
Exercice ORGA2-1 : Évolution du nombre d'onde de la vibration d'élongation C=O
On rappelle les domaines de nombres d'onde pour l'élongation de la liaison C=O :
1750 – 1850 cm-1 : anhydride d'acide
1770 – 1820 cm-1 : chlorure d'acyle
1730 – 1750 cm-1 : ester
1700 – 1740 cm-1 : aldéhyde, cétone
1680 – 1720 cm-1 : acide carboxylique
1630 – 1700 cm-1 : amide
1. Comparer la force de la double liaison C=O des acides et dérivés d'acides avec celle des dérivés
carbonylés.
2. Interpréter cela à l'aide des effets électroniques du groupement -Z.
Exercice ORGA2-2 : Action du diazométhane sur un acide carboxylique
Le traitement de l'acide éthanoïque par une solution éthérée de diazométhane conduit à un dégagement
gazeux et un produit A dont le spectre IR ne présente pas de bande au-delà de 3100 cm-1 et présente une
bande fine et intense vers 1740 cm-1, et le spectre RMN comporte deux singulets intégrant chacun pour
3H.
1. Le diazométhane a pour formule semi-développée H2CN2 (l’enchaînement des atomes est respecté).
Proposer des formes mésomères pour ce composé.
2. Le diazométhane peut jouer le rôle de base. La réaction est alors sous contrôle de charge. À l'aide de la
répartition des charges de Mulliken obtenue par calcul, indiquer la forme mésomères ayant le plus fort
poids.
3. La première réaction entre l'acide éthanoïque et le diazométhane est une réaction acide-base. Écrire
l'équation de réaction puis donner le mécanisme de formation de A. quelle est la nature du dégagement
gazeux ? Justifier la facilitée de la réaction.

PC 2016 – 2017 Lycée La Martinière Monplaisir
ORGA2 – Addition nucléophile suivie d'élimination TD n°10 – 2 / 2
Exercice ORGA2-3 : Polyesters furaniques
Les polyesters furaniques sont des polymères photosensibles (sensibilité aux radiations UV) utilisés en
industrie graphique. Par ailleurs, comme nous allons le voir dans ce qui suit, ils sont synthétisés à partir
de dérivés du furane issus de la biomasse et constituent donc une alternative aux polymères issus de
dérivés pétroliers.
Le diacide furanacrylique de départ est représenté ci-après :
Le diacide furanacrylique est chauffé à reflux en présence de chlorure de thionyle (SOCl2) et de
diméthylformamide pendant 4 h. Le produit obtenu A réagit avec l'éthanol dans le solvant
dichlorométhane et en présence de triéthylamine. La phase organique est lavée puis traitée par du sulfate
de sodium anhydre. On obtient B.
1. Donner les formules semi-développées de A et B.
2. Quel est le rôle de la triéthylamine ? Quel est le rôle du sulfate de sodium anhydre ?
Le composé B peut ensuite participer à des polymérisations par trans-estérification en réagissant par
exemple avec un diol aliphatique comme l'hexane-1,6-diol.
3. En mettant le même nombre stœchiométrique n pour l'hexane-1,6-diol et pour B, donner l'équation de
la réaction de polymérisation conduisant à une macromolécule linéaire, en précisant les formules
topologiques des produits.
Exercice ORGA2-4 : Synthèse de l'acide pantothénique
1. On traite l'éthanoate d'éthyle par un excès de méthanol en milieu sulfurique.
Qu'obtient-on ? Quel est le mécanisme ?
2. Le produit obtenu est placé dans un excès d'ammoniac. Qu'obtient-on ?
On dispose de l'ester cyclique ou lactone A.
On prépare l'autre réactif D ainsi.
Le passage de B à C est analogue à l'hydrogénation des alcynes.
3. Identifier B, C et D.
4. L'action de A sur D est analogue à la réaction vue en 2. et donne E qui, par saponification dans des
conditions douces puis neutralisation, donne l'acide pantothénique F. Expliciter les réactions.
O
OH
O
HO
O
A
O
O
OH
B C
Cl COO
KCN
CH3OH
H+D
Ni de Raney
1/ 2 H2
2/ H+
1
/
2
100%