Gestion péri-opératoire des anticoagulants

GESTION PÉRI-OPÉRATOIRE
DES ANTICOAGULANTS
Pierre Albaladejo (1), Emmanuel Marret (2), Annick Steib (3)
(1) CHU Henri Mondor, 51 avenue de Lattre de Tassigny, 94010 Créteil
(2) CHU Tenon, 4 rue de la Chine, 75970 Paris Cedex 20
(3) CHU Hautepierre, 1 avenue Molière, 67098 Strasbourg
INTRODUCTION : LA BALANCE « RISQUE-RISQUE »
Alors qu’en médecine classique, c’est la balance bénéfice-risque qui conduit
à la prescription d’un traitement ou la réalisation d’un acte, il existe des situations
spécifiques à la période péri-opératoire. Ce sont les situations particulières où
un traitement est incompatible avec la réalisation d’un acte chirurgical. Le cas
le plus illustratif est celui de la gestion péri-opératoire des médicaments anti-
thrombotiques. En effet, dans ces situations, l’arrêt des anti-thrombotiques
expose à un risque thrombotique (valve, fibrillation auriculaire, stents coronaires,
etc…), le maintien des anti-thrombotiques aboutit à un risque hémorragique.
Or, il n’est pas toujours aisé de juger de l’impact d’un événement lié à une de
ces 2 attitudes et surtout de comparer l’impact des 2 types d’événements : par
exemple, infarctus du myocarde et hématome postopératoire. Ces 2 événements
ont un impact très différent en fonction de leur gravité : l’infarctus du myocarde
peut par définition correspondre à une mise en circulation limitée de troponine
sans impact immédiat sur le pronostic cardiovasculaire ou bien à un événement
catastrophique s’il s’agit d’une thrombose de stent. A contrario, une thrombose
de valve ou une embolie systémique ont des conséquences dramatiques en
terme pronostic. Face à ce risque, un hématome postopératoire peut conduire à
une reprise chirurgicale simple sans impact majeur sur le pronostic ou bien aboutir
à des conséquences infectieuses catastrophiques s’il s’agit d’une prothèse de
hanche par exemple. Comparer les deux types d’événements n’est pas aisé. La
littérature médicale nous fournit des incidences ou des fréquences d’événement.
Or, chaque événement a un poids différent (AVC ischémique versus hémorragie
per ou postopératoire). Les stratégies reposant forcément sur la comparaison
de ces événements sont fondées sur la valeur que leur donne chaque médecin
intervenant dans la prise en charge du patient (chirurgien non cardiaque, chirurgien
cardiaque, anesthésiste, cardiologue) et idéalement celle que leur donne les
patients. C’est dire l’importance de l’information dans ces discussions.

MAPAR 2007
146
INTRODUCTION : GESTION PÉRI-OPÉRATOIRE DES AVK
Les antagonistes de la vitamine K (AVK) sont indiqués en prévention primaire
et secondaire de la maladie veineuse thromboembolique et de l’embolie pulmo-
naire, pour la prévention des embolies systémiques chez les patients en fibrillation
auriculaire ou porteurs de valves prothétiques cardiaques, pour la prévention des
accidents vasculaires cérébraux et la récidive des infarctus du myocarde.
La prise en charge péri-opératoire d’un patient traité par AVK pose le double
problème du risque hémorragique lié au traitement et du risque thrombotique
induit par sa suspension. Le degré d’urgence de la chirurgie représente le
troisième trublion.
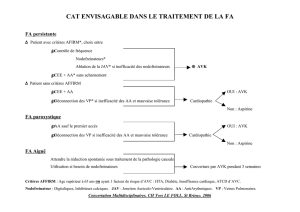
Pour les actes programmés, il est classique de proposer un arrêt préopé-
ratoire temporaire des AVK associé le plus souvent à un relais par héparine.
Néanmoins, une large réflexion s’est engagée récemment :
• Sur l’opportunité d’arrêter les AVK dans tous les cas, quel que soit le geste
envisagé.
• Sur la proposition d’un relais substitutif systématique préopératoire.
• Sur la nature de ce relais.
En effet, la plupart des recommandations actuelles disponibles dans la
littérature relèvent d’avis d’experts, ne reposant pas sur des études de niveau
de preuve élevé. Des recommandations pour la pratique clinique (RPC) compre-
nant un volet sur la gestion péri-opératoire des AVK est actuellement en cours
d’élaboration sous l’égide de la Haute Autorité de Santé et de l’Agence Française
de Sécurité Sanitaire et des Produits de Santé. Les conclusions de ce référentiel
médical seront rendues fin 2007.
1. RISQUES LIÉS À LA POURSUITE OU L’ARRÊT DU TRAITEMENT
1.1. RISQUE HÉMORRAGIQUE LIÉ AU GESTE EN CAS DE POURSUITE DU
TRAITEMENT
Le risque hémorragique dépend de l’intensité du traitement, des types
d’actes de chirurgie, d’investigation ou d’anesthésie vulnérants. L’estimation du
risque de saignement en cas de poursuite du traitement est difficile à appré-
hender pour les AVK.
En l’absence de tout traitement anticoagulant, les actes spontanément recon-
nus à risque hémorragique sont les interventions neurochirurgicales, la chirurgie
urologique (incluant les biopsies rénales), la chirurgie carcinologique majeure, la
chirurgie cardiaque et vasculaire majeure, la chirurgie orbitaire. Parmi les actes
interventionnels, on relève la sphinctérotomie endoscopique et la polypectomie
intestinale. Ce risque hémorragique est lié aux pertes sanguines prévisibles
mais aussi aux difficultés rencontrées (accès difficile pour l’hémostase) voire
aux conséquences fonctionnelles gravissimes potentielles d’une extravasation
minime de sang (hématome intracrânien ou périmédullaire, chirurgie de l’oreille
moyenne et du vitré). Le rôle de l’opérateur n’est pas négligeable [1]. La chirurgie
orthopédique, digestive et thoracique sont à risque modéré.
Le risque hémorragique sous AVK croît très rapidement quand l’INR est
supérieur 4. Il est classiquement admis qu’un INR inférieur à 1,5 permet la
réalisation de la majorité des gestes de chirurgie ou d’investigation [1]. Pour
ce qui est de l’anesthésie les cas d’hématomes périmédullaires décrits dans

Questions pour un champion en anesthésie 147
la littérature anglo-saxonne sous AVK [2] concernent tous des situations où le
retrait du cathéter s’est effectué en situation d’hypocoagulabilité avec INR élevé
(1,6 à 6,3). Chez les patients bénéficiant de faibles doses de warfarine à titre
prophylactique, aucun incident n’a été décrit lors du retrait du cathéter (INR
~1,4) [3].
1.2. RISQUE THROMBOTIQUE LIÉ AU PATIENT EN
L’
ABSENCE D’ANTICOA-
GULATION
Une anticoagulation efficace n’élimine pas tout risque thromboembolique
mais le réduit par rapport à l’absence d’anticoagulation. Cette différence peut
être appréhendée par le calcul du risque annuel et le risque journalier (risque
annuel/365) pour les deux situations (Tableau I). L’estimation du risque throm-
boembolique est également possible par le biais d’études observationnelles
s’intéressant à la prise en charge péri-opératoire des patients traités. Des
différences ont été observées en essayant de superposer le risque calculé et
le risque observé [4]. Elles pourraient résulter d’un effet rebond lié à l’arrêt des
AVK [5] ou à un effet prothrombotique induit par la chirurgie. Ces données étant
difficiles à valider par des études bien menées, le risque de thrombose est en
général classé en 3 catégories : faible, modéré ou élevé selon que le risque annuel
calculé est < à 3 %, compris entre 4 à 7 % ou > à 8 %. (Tableau II) [6].
Tableau I
Risque thromboembolique annuel avec ou sans anticoagulation. FA : fibrilla-
tion auriculaire, MVTE : maladie veineuse thromboembolique [6]
Sans AVK Sous AVK
FA isolée 1- 4,5% 1,5%
FA et AVC antérieur 12-15% 1,7%
Valve mécanique
• aortique
• mitrale
4%
8% (4-12% ?)
0,7%
1,1% (0,9-1,5%)
Récidive MVTE 20% 2,5-7,5%
Tableau II
Facteurs de risque thrombotique chez des patients traités par AVK [1]. Les
facteurs de risque sont l’âge supérieur à 75 ans, diabète, HTA, antécédents
d’AVC et d’AIT, insuffisance VG. ETE : événement thromboembolique.
AC APL : anticorps antiphospholipide
Valve FA MVTE
Risque
Elevé
AVC-AIT< 1mois
Aortique à bille
Position mitrale
AVC-AIT<1mois
Atteinte mitrale d’origine
RAA
ETE <1mois
Cancer
AC APL
Insuffisance cardiaque
Insuffisance respira-
toire
Risque
modéré
Position aortique
disque ou ailette
et 2 facteurs de risque
d'AVC ou plus
FA chronique et
2 facteurs de risque ou
plus d’AVC
ETE < 6mois
ETE après % AVK
Risque
faible
Position aortique et
< 2 facteurs risque
d’AVC
FA chronique et < 2
facteurs risque d’AVC
Absence de facteurs de
risque

MAPAR 2007
148
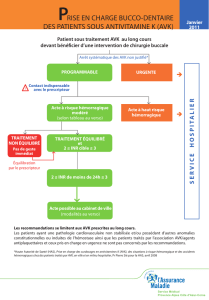
2. QUE FAIRE DU TRAITEMENT AVK EN PRÉOPÉRATOIRE ?
2.1. RISQUE HÉMORRAGIQUE FAIBLE
Dans un certain nombre de situations il est possible d’effectuer un acte
chirurgical sans arrêter le traitement par AVK car le risque hémorragique de la
chirurgie est minime et/ou aisément contrôlable. Les actes concernés sont la
chirurgie dentaire, la chirurgie cutanée, la chirurgie de la cataracte. Des recom-
mandations ont été publiées pour la gestion des extractions dentaires sous
AVK [7]. Les conditions requises associent l’éviction des agents interférant avec
l’hémostase (AINS, antibiotiques), l’utilisation de moyens hémostatiques (colles,
compresses résorbables, bains de bouche à l’acide tranexamique, compression
locale par morsure) et le maintien de l’INR dans la zone thérapeutique (INR 2-4).
Des études menées en dermatologie permettent d’envisager la chirurgie de
surface sous traitement [8]. Une étude de cohorte réalisée en ophtalmologie
dans la chirurgie de la cataracte chez 19 283 patients dont 681 étaient sous AVK
a montré l’absence de complications hémorragiques lorsque le traitement était
maintenu [9]. Dans ce cas, le maintien des AVK requiert un réajustement des
techniques anesthésiques, privilégiant la réalisation d’anesthésies topiques.
2.2. RISQUE HÉMORRAGIQUE MODÉRÉ OU ÉLEVÉ
Si la chirurgie ou l’acte interventionnel exposent à un risque hémorragique,
il est préférable d’arrêter le traitement. Dès lors se discutent deux points :
• Combien de temps faut-il arrêter les AVK avant l’intervention ?
• Faut-il relayer par un autre traitement anticoagulant plus maniable jusqu’au
jour de l’intervention ?
Cette discussion doit tenir compte du risque thrombotique défini précé-
demment.
• Chez le patient à risque thrombotique faible (< 3 %), le traitement peut être
arrêté 3 à 5 jours avant l’opération pour permettre à l’INR de se normaliser.
Pour atteindre un seuil de sécurité d’INR de 1,5, un arrêt de 48 à 72 heures est
suffisant pour les AVK de demi-vie courte comme l’acénocoumarol (Sintrom®) ;
72 heures ou plus sont nécessaires pour un traitement par fluindione (Prévis-
can®) ou warfarine (Coumadine®) Le relais préopératoire n’est pas nécessaire.
Les AVK seront repris rapidement après l’intervention.
• Chez le patient à risque thrombotique modéré, on peut être tenté de proposer
un relais. Cependant les données de la littérature ont récemment montré [10]
à partir de calculs de simulation que seule une incidence potentielle de risque
d’AVC > 5,6 % par an justifiait d’une substitution péri-opératoire à doses
anticoagulantes. Les auteurs concluent que la majorité des patients porteurs
d’une valve mécanique aortique ou ayant une FA prise en charge sans relais
avaient une espérance de qualité de vie identique à ceux substitués à pleine
dose. Seuls les patients à haut risque d’AVC (valves mécaniques mitrales)
tireraient bénéfice du relais.
• Chez le patient à risque thrombotique élevé, la substitution s’avère nécessaire.
Les modalités de relais font l’objet de nombreuses discussions. Si le choix
de l’héparine fait l’unanimité, celui de la molécule (héparine non fractionnée :
HNF versus héparine de bas poids moléculaire : HBPM) est controversé dans
la mesure où les HBPM n’ont pas l’AMM dans cette indication. Les recom-
mandations nord américaines [11] publiées en 2004 restaient imprécises,

Questions pour un champion en anesthésie 149
suggérant l’emploi de l’HNF et des HBPM, à doses préventives ou curatives
chez les patients à risque thrombotique intermédiaire ou élevé. Aucune recom-
mandation n’était faite dans le cadre particulier des patients porteurs de valves
mécaniques [12]. L’héparine non fractionnée est proposée sous administration
continue avec les contraintes inhérentes à son utilisation : hospitalisation,
monitorage régulier du TCA. Elle peut également être injectée par voie sous-
cutanée à raison de 400 UI.kg-1
.j-1 en 2 ou 3 injections. Cette dernière modalité,
satisfaisante sur le plan cinétique est difficile à réaliser sur le plan pratique
chez des malades à domicile. L’emploi des HBPM en place de l’HNF a fait
son chemin et des études récentes permettent de faire le point sur ce sujet.
L’étude REGIMEN comparant HNF et HBPM dans un essai observationnel
multicentrique a montré l’absence de différence entre ces 2 médicaments
pour ce qui est de l’incidence de saignement majeur (1 %) et d’événement
thrombotique (3,8 %). Cependant, les HBPM étaient moins souvent proposées
pour la chirurgie majeure ou en cas d’anesthésie générale dans cette étude [13].
Un autre registre prospectif incluant 650 patients à risque artériel élevé [14] a
montré que l’emploi de daltéparine en relais pré et postopératoire était associé
à un faible risque hémorragique et thrombotique. Deux études prospectives ont
été menées avec les HBPM ; la première [15] avec la daltéparine, la seconde
avec l’enoxaparine [16]. La première montre la faisabilité du relais, la seconde
que des études complémentaires sont nécessaires pour la chirurgie majeure ;
en effet, des saignements plus importants ont été rapportés, comparés à la
chirurgie mineure ou aux gestes invasifs. La synthèse des études publiées [6]
a révélé une incidence globale de 2,68 % d’évènements hémorragiques
graves et de 1,04 % d’évènements thrombotiques pour un nombre total de
1 642 patients chez qui le relais pré et postopératoire a fait appel à des HBPM.
Chez les patients porteurs de valves mécaniques, l’incidence globale des
saignements majeurs serait de 2,8 % ; celle des thromboses de 0,4 % en se
référant à 749 patients issus de 5 études [17].
CONCLUSION
L’arrêt préopératoire des AVK n’est pas indispensable pour tous les actes
réalisés en chirurgie ou en dehors du bloc opératoire. Si cet arrêt est nécessaire
avant l’intervention, il n’est pas indispensable de relayer les AVK dans tous les
cas. En cas de relais, les HBPM sont de plus en plus souvent proposées, mais
restent à évaluer à grande échelle. D’autres possibilités sont également explorées
telles l’absence d’arrêt préopératoire associé à l’administration d’une petite dose
de vitamine K la veille de l’opération pour corriger rapidement l’INR.
RÉFÉRENCES BIBLIOGRAPHIQUES
[1] Douketis JD. Perioperative anticoagulation management in patients who are receiving oral
anticoagulant therapy : a practical guide for clinicians. Thromb Res 2003;108:3-13
[2] Horlocker TT, Wedel DJ, Benzon H, Brown DL, Enneking FK, Heit JA, Mulroy MF, Rosenquist
RW, Rowlingson J, Tryba M, Yuan CS. Regional anesthesia in the anticoagulated patient: defining
the risks. Reg Anesth Pain Med 2003;28:172-197
[3] Wu CL, Perkins FM. Oral anticoagulant prophylaxis and epidural catheter removal. Reg Anesth
Pain Med 1996;21:517-524
 6
6
1
/
6
100%