les alcools - H

LES ALCOOLS
Objectifs du cours
Connaître les trois classes d’alcool.
Connaître les méthodes de préparation d’un alcool
Connaître les propriétés chimiques des alcools.
Connaître la nature et les noms des produits d’oxydation des alcools primaire et secondaires
Connaître la nomenclature des aldéhydes et des cétones et les réactifs qui permettent de les
identifier
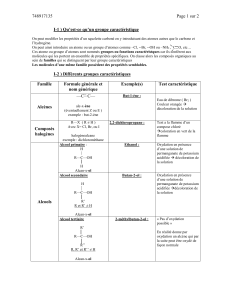
1. Alcools
1.1. Définition
C’est un composé organique comportant un groupement fonctionnel hydroxyle (-OH). La formule
brute d’un alcool dérive de celui de l’alcane correspondant en remplaçant la terminaison « e » de
l’alcane par « ol ».
1.2. Les trois classes d’alcool
Classe
Alcool primaire
Alcool secondaire
Alcool tertiaire
Nombre d’atomes de carbone auquel le
carbone fonctionnel est lié
0 ou 1
2
3
Formule semi-développée
Remarque : sont des groupes carbonés (ils sont différents de H).
1.3. Polyols ou polyalcools
Ce sont les molécules qui possèdent plusieurs groupes hydroxyles OH.
Exemples :
Formules semi-développée
Nom
Glycol
(ou éthan-1,2-diol)
glycérol
(ou propan-1,2,3-triol)
1.4. Préparation des alcools
hschool.ci | Apprendre - Tester - Partager

En milieu aérobie(en présence d’air), l’éthanol peut-être obtenu par la fermentation
des jus sucrés (ananas, pomme, vin de palme, etc.)
En milieu acide, l’hydratation d’un alcène conduit à un alcool.
NB : pour le cas d’un alcène dissymétrique o applique la règle de Markovnikov qui
dit que l’hydratation d’un alcène conduit de façon majoritaire à l’alcool dont ma
classe est le plus élevée.
1.5. Propriétés chimique des alcools
La déshydratation en présence d’alumine d’un alcool conduit à un alcène.
Le sodium réagit avec les alcools selon une réaction d’oxydoréduction :
Alcool alcoolate de sodium
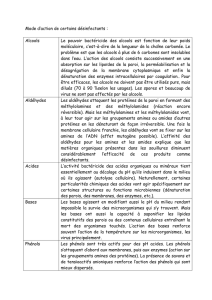
2. Aldéhydes et Cetones
2.1. Définition
Composés carbonylés
Aldéhydes
Cétone
Formule Générale
Groupe fonctionnel (Carbnyle)
commun
Formule brute commune
2.2. Nomenclature des aldéhydes
Pour nommer un aldéhyde, on remplace « e » final de l’alcane correspondant par le suffixe « -al ». le
principe est le suivant :
Déterminer la chaîne principale contenant le carbone fonctionnel ;
Si la molécule est ramifié, numéroter les carbones de la chaîne principale de telle sorte que le
carbone fonctionnel porte toujours l’indice 1.
Exemples :
Ethanal
3-méthylbutanal
2-éthyl-3-méthylpentananal
hschool.ci | Apprendre - Tester - Partager

2.3. Nomenclature des cétones
Pour nommer une cétone, on remplace le « e » final de l’alcane correspondant par le suffixe « -one ».
le principe est le suivant :
Déterminer la chaîne principale contenant le carbone fonctionnel ;
Indiquer, si nécessaire, l’indice du groupement fonctionnel. Ce indice doit être le plus bas
possible et est placé entre le préfixe indiquant le nombre de carbone de la chaîne principale
et le suffixe « -one » ;
Si la la molécule est ramifié procéder comme chez les hydrocarbures.
Exemples :
Propanone 3-méthylpentan-2-one 4-méthylhexan-3-one
2.4. Quelques propriétés chimiques
Les aldéhydes et les cétones donnent avec la DNPH un précipité jaune (propriété
commune).
Les aldéhydes rosissent le réactif de Schiff.
Les aldéhydes réduisent l’ion diamine argent en donnant un dépôt d’argent (ré actif
de Tollens).
Les aldéhydes réduisent la liqueur de Fehling en donnant un précipité rouge brique.
3. Oxydation des alcools
3.1. Combustion
Les alcools réagissent avec le dioxygène pour donner du dioxyde de carbone et de l’eau.
3.2. Oxydation ménagée
a. Oxydation en fonction de leur classe
hschool.ci | Apprendre - Tester - Partager

b. Oxydation par l’oxygène de l’air
C’est l’expérience de lampe sans flamme. Elle se fait en présence de cuivre (Cu) ou de platine (Pt).
Exemple :
En présence de cuivre ou de platine, l’éthanol brûle dans l’oxygène de l’air pour donner
successivement l’éthanal puis l’acide éthanoïque.
c. Oxydation par un oxydant
Elle se fait en présence d’une solution acidifiée de permanganate de potassium ou de
bichromate de potassium
Les ions dichromate
et permanganate
sont obtenu en dissolvant respectivement
les composés ioniques et dans l’eau.
Equations-bilan de dissolution
Couple oxydant réducteur et demi-équation électronique
Un couple oxydant/réducteur se note Ox/Red.
Sa demi-équation électronique est donnée par :
Un couple oxydant/réducteur se note Ox/Red. Sa demi-équation électronique est donnée par :
Exemples :
:
4. Méthode pratique
Comment écrire l’équation-bilan d’une réaction d’oxydation d’un alcool.
- Déterminer les couples oxydant/réducteur en présence ;
- Ecrire les demi-équations électroniques des couples en présence ;
- Multiplier ces demi-équations par les coefficients qu’il faut pour avoir le même nombre
d’électrons dans une demi-équation ;
- Additionner membre à membre les deux demi-équations ;
- Simplifier les termes apparaissant à la fois dans les deux membres ;
hschool.ci | Apprendre - Tester - Partager

- Transformer les ions en ion en ajoutant le nombre de molécules d’eau qu’il
faut à chacun des membres de l’équation-bilan (nécessaire si demandé)
Exemple : équation-bilan de l’oxydation de par l’ion permanganate en défaut.
5. Tableau récapitulatifs de quelques réactions
Aldéhyde
Cétone
Alcool primaire
ou secondaire
Alcool
tertiaire
Acide
carboxylique
2,4-DNPH
Précipité jaune
Précipité
jaune
Rien
Rien
Rien
Réactif de
Schiff
Rien
Rien
Rien
Rien
Rien
Réactifs de
Tollens
Dépôt d’argent
Rien
Rien
Rien
Rien
Liqueur de
Fehling
Précipité rouge
brique
Rien
Rien
Rien
Rien
Papier PH
Rien
Rien
Rien
Rien
Rien
Solution
oxydante
+H2SO4
concentré
Décoloration
Rien
Décoloration
Rien
rien
hschool.ci | Apprendre - Tester - Partager
1
/
5
100%