Oxydoréduction

1
Sciences Physiques 1S S. Zayyani
Fiche de Cours
Unité : Mesures en chimie
Chapitre: Chapitre 6 – Réactions oxydo-réduction
Oxydants et réducteurs & Couple Redox
Même si on l’introduit concrètement pour la première fois ici, vous avez déjà rencontré la notion d’une
réaction d’oxydoréduction en 3eme, et plus récemment dans le chapitre précédent ! En effet les réaction entre
les acides et les métaux, ainsi que les piles électrochimiques que l’on a construite en 3eme sont différents
exemples des réaction d’orn. Le fil conducteur dans les différent cas est l’importance centrale des électrons
mis-en-jeu.
DÉFINTION :
Un oxydant est une espèce chimique capable de gagner (ou capter) des électrons C'est-à-dire :
On dit que l’oxydant se réduit.
Une réduction est donc une capture d’électrons.
+ é
Exemple : Les ions de cuivre (II) se réduisent
++ 2=
dans cette réaction, les ions + sont les oxydant (car ils captent des électrons), le
métal cuivre est le réducteur (car il est capable de perdre ses électrons, dans la
réaction inverse), et la réaction est une réduction (car il s’agit d’une capture
d’électrons).
Un réducteur est une espèce chimique capable céder (ou
perdre) des électrons. C'est-à-dire :
On dit que lors de cette réaction le réducteur s’oxyde.
Une oxydation est donc une perte d’élection.
+
Exemple : Le métal Zinc s’oxyde :
= ++ 2
dans cette réaction, le métal est le réducteur (car ils céde des électrons), l’ion
+ est l’oxydant (car il est capable de capter des électrons, dans la réaction
inverse), et la réaction est une oxydation (car il s’agit d’une perte d’électrons).
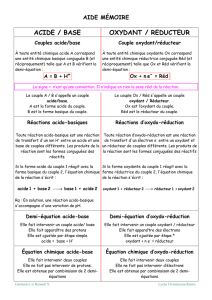
REMARQUE : Notons déjà les parallèles avec les acides et les bases :
Dans les réaction A/B la particule échangée est un proton +

2
Dans une réaction O/R la particule échangée est un électron
Donc, si on raisonne comment pour les acides et les base nous pouvons introduire la notion d’un couple
oxydant/réducteur :
DÉFINTION :
Une espèce oxydante et une espèce réductrice forme un couple oxydant/réducteur (O/R) si l’on peut
passer de l’une à l’autre par gain ou perte d’électron(s).
Un tel couple est noté ox/red (l’oxydant noté toujours d’abord, à gauche).
On parle donc d’oxydante et de réducteur conjugué.
Selon les conditions expérimentales, on peut observer la transformation dans un des deux sens :
+ +
on associe donc à un couple o/r une demi-équation d’oxydoréduction (appelée aussi redox) :
+ =
Comme d’habitude, les principes sont assez simples et directs, mais dans l’application on peut toujours
rencontrer des difficultés.
Trouver la demi-équation d’un couple est très important, et pas toujours évident. Il faut exploiter de
différentes propriétés des réactions chimiques : la conservation de tous les éléments, la conservation de la
charge électrique, etc. Donc voici une méthode générale pour équilibrer les demi-équations d’un couple
1.
Ecrire l’ébauche de la demi-équation sans les coefficients stœchiométriques
2.
Equilibrer les atomes de l’élément commun à l’oxydant et au réducteur.
3.
Equilibrer les atomes d’oxygène en ajoutant des molécules d’eau ().
4.
Equilibrer les atomes d’hydrogène avec les ions ()
+.
5.
Equilibrer les électrons en utilisant des électrons .
Maintenant étudions quelques couples importants :
Couple cation métallique/métal
les métaux ont tendance à former des cations. D’une manière générale on désigne un métal par la lettre (),
et son cation ()
+. Donc la demi-équation de ce couple est :
Le couple ()
+/() :
Couples Ion monoatomique et molécule
1) Le couple ()
+/ () : ce couple très prévalent est un des couples présents lors des réaction entre les
acides et d’autres substance (e.g. attaque d’un métal par un acide).

3
2) Le couple ()/()
(diiode/iodure) : un couple utilisé souvent dans les dosages.
Couples dans lesquels un élément commun s’associe à l’oxygène
1) Le couple 46 ()
2/23 ()
2 (tétrathionate/thiosulfate) :
2) Le couple 2 ()/() : Ce couple est un couple très important en chimie. Il intervient dans les
réactions de corrosion des métaux placés au contact de solutions aqueuses contenant du dioxygène. Il est
mis-en-jeu également dans le processus de la respiration.
3) Le couple ()
/()
+ (permanganate/ion manganèse II) : Ce couple a une demi-équation un peu
compliquée. Suivons alors les étapes données précédemment :
Etape 1)
Etape 2)
Etape 3)
Etape 4)
Etape 5)

4
4) Le couple ()
/()
+ (dichromate/ion de chrome III) : le dichromate a une couleur jaune alors que
son réducteur conjugué, l’ion de chrome III est de couleur verte.
Voici un tableau récapitulatif :
Couple
Oxydant
Réducteur
Demi-équation redox
()
+/ ()
()
+/()
()
+/()
+
()/()
()
/()
+
()
/ ()
()/()
()
/()
+
QUELQUES REMARQUES :
Il est très important de noter que les transformations étudiées dans ce chapitre on lieu en solution
aqueuse, mais que comme les électrons libres ne peuvent exister en solution, cette écriture est
formelle et constitue une schématisation.
Tous les électrons perdus par le réducteur sont donc captés par l’oxydant.
Lorsque la présence des ions ()
+ est nécessaire afin d’équilibrer
la demi-équation, cela indique que la réaction a lieu dans un
milieu acide (ou milieu acidifié).
Il y a bien un lien entre la structure électronique d’un élément,
son placement dans la classification périodique et son caractère
oxydant ou réducteur. Les principaux réducteurs sont les
métaux et les alcalins-terreux. Les principaux oxydants sont les
corps simples (en particulier le dioxygène), et les dihalogènes.

5
Réactions d’oxydoréduction
DÉFINTION :
Une réaction d’oxydoréduction, aussi appelée une réaction redox, est une réaction caractérisée par un
tranfert d’électrons entre deux réactifs : l’oxydant et le réducteur.
Il s’agit donc d’une réaction entre deux couple redox.
L’oxydant d’un couple réagit avec le réducteur de l’autre couple, et les produits de la réactions sont le
reducteur et l’oxydant conjugué.
L’équation chimique redox entre les couples / + 1
/ + 2 sera :
+ 1 é
+ 2
Afin d’équilibrer les réactions, il faut faire intervenir les coefficients stoechiométriques 1 2 , et on
obtient la réaction redox
2+ 1 1+ 2
EX|| Trouver la réaction redox entre les couples suivants :
1) Argent ()
+/() et cuivre ()
+/()
2) Aluminium ()
+/() et dihydrogène ()
+/2 ()
3) Permanganate 4 ()
/()
2+ et étain ()
+/()
+
 6
6
 7
7
 8
8
 9
9
1
/
9
100%