Maniement des médicaments antipaludéens chez le patient

L a L e t t r e d ’ I C A R e n N É P H R O L O G I E
A vec l e pa rr a ina g e d e la So c ié t é d e N éphr o log ie e t d e la So c ié t é Fra n copho n e de D ia lyse
Comité Scientifique
Yvon Berland, Marseille
Gilbert Deray, Paris
Maurice Laville, Lyon
Coordinateur National
Vincent Launay-Vacher, Paris
Coordinateurs Régionaux
Philippe Brunet, Marseille
Jean-Pierre Fauvel, Lyon
Svetlana Karie, Paris
Maniement des médicaments antipaludéens chez le patient insuffisant rénal
Le paludisme touche 300 à 500 millions d'individus et provoque
la mort d'un à trois millions d'entre eux par an [1]. Sa répartition
géographique s'étend sur plus de 90 pays, essentiellement
localisés dans les régions tropicales, l'une des premières
destinations touristiques. Le paludisme est la première maladie
d'importation chez le voyageur. La chimioprophylaxie est ainsi
cruciale dans les pays endémiques pour Plasmodium falciparum.
Chez le patient présentant une altération de la fonction rénale, la
pharmacocinétique des médicaments antipaludéens peut être
modifiée et nécessiter une réduction des posologies.
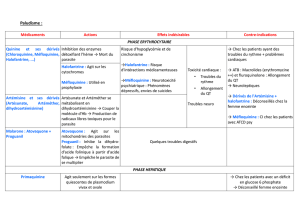
La Chloroquine est métabolisée dans le foie par le cytochrome
P450 en un métabolite actif. Le médicament est éliminé de façon
importante dans les urines sous forme active (molécule-mère 50
% et métabolite 23 %). Chez les patients insuffisants rénaux, la
demi-vie d’élimination est significativement augmentée [2]
nécessitant une réduction de la posologie.
Le Proguanil est métabolisé dans le foie par le cytochrome
P450 en deux métabolites dont l’un, le cycloguanil, est
responsable de l’activité thérapeutique et de la toxicité
hématologique. L’excrétion rénale sous forme active représente
25 à 60 % de la dose administrée [3]. Dans une étude, chez 27
patients insuffisants rénaux, une augmentation de l’exposition
systémique (AUC) et de la demi-vie d’élimination du
proguanil et de ses métabolites a été observée. De plus, il
existe plusieurs cas rapportant une mauvaise tolérance
hématologique et digestive du proguanil chez les patients
insuffisants rénaux [4,5].
L’Atovaquone est majoritairement excrétée par voie biliaire.
L'élimination urinaire est négligeable (0,6 %) [6]. Une
adaptation de la dose n’est pas nécessaire chez le patient
insuffisant rénal.
La Méfloquine est transformée par le foie en deux métabolites
inactifs. L'élimination rénale sous forme inchangée est faible (2
à 9 %). L'absence de modifications pharmacocinétiques chez des
patients hémodialysés a été rapportée après l'administration
d’une dose de 250 mg par semaine pendant 2 semaines [7].
L’adaptation de la posologie n’est donc pas nécessaire chez le
patient insuffisant rénal.
La Doxycycline est éliminée à 46 % dans les urines sous forme
active. Cependant, en cas d'insuffisance rénale, la demi-vie
d'élimination reste inchangée. En effet, la diminution de
l'élimination urinaire est compensée par une augmentation de
l'élimination fécale [8]. Il n'est donc pas nécessaire d'adapter la
posologie chez le patient insuffisant rénal.
Clairance de
la créatinine
(ml/min)
Nivaquine®
Chloroquine
Comprimé 100 mg
Sirop 25 mg/5 ml
Paludrine®
Proguanil
Comprimé 100 mg
Savarine®
Chloroquine (100 mg)
+ Proquanil (200 mg)
Malarone®
Proguanil (100 mg)
+ Atovaquone (250 mg)
Lariam®
Méfloquine
Comprimé
250 mg
Doxypalu®
Doxycycline
Comprimé
100 mg
80-90 : 1 comprimé par jour
90-60
100 à 50 mg/jour
200 mg/jour
60-80 : administrer les deux
principes actifs séparément
1 comprimé par jour
250 mg/semaine
100 mg/jour
60-40 : 50 mg/jour
60-40 : 1/2 comprimé
60-30
40-30 : 50 à 25 mg/jour
100 mg/jour
40-30 : administrer les deux
principes actifs séparément
250 mg/semaine
100 mg/jour
30-15
25 mg/jour
50 mg toutes les 48 h
250 mg/semaine
100 mg/jour
<15 et HD
12,5 mg/jour
Après la séance
50 mg par semaine
Après la séance
250 mg/semaine
Après la séance
100 mg/jour
Non dialysable
DPCA
12,5 mg/jour
50 mg par semaine
Administrer les deux
principes actifs séparément
Administration impossible
Adaptation de la dose du proguanil
mais pas de l’atovaquone.
La forme pharmaceutique ne
permet pas l’administration
séparée des 2 principes actifs
Choisir une alternative
250 mg/semaine
100 mg/jour
HD : Hémodialyse ; DPCA : Dialyse Péritonéale Continue Ambulatoire
D'après l'Organisation Mondiale de la Santé, les pays peuvent
être divisés en 3 groupes en fonction de la fréquence et de
l'importance des résistances aux traitements antipaludéens.
Pays du groupe 1 : pas de Plasmodium falciparum, pas de
résistance à la chloroquine : chloroquine.
Pays du groupe 2 : zones de choroquinorésistance :
chloroquine+proguanil ou atovaquone+ proguanil.
Pays du groupe 3: prévalence élevée de
chloroquinorésistance et risque de multirésistance :
méfloquine ou doxycycline ou atovaquone+ proguanil.
Le 31 Mars 2006
Groupe 1: Argentine (nord), Azerbaïdjan (sud), Belize, Bolivie (sud), Cap-Vert, Chine (nord-est), Costa Rica, Egypte, Guatemala, Haïti, Honduras, Ile Maurice, Irak, Iran (sauf sud-est), Maroc, Mexique
(Chiapas), Nicaragua, Panama (nord), Paraguay (est), Pérou (ouest), République dominicaine, El salvador, Syrie, Tadjikistan (sud), Turquie.
Groupe 2: Afghanistan, Afrique du Sud (Transval, Natal), Arabie saoudite (ouest), Bénin, Bhoutan, Bostawana, Burkina Faso, Côte d'Ivoire, Emirats Arabes Unis, Gambie, Ghana, Guinée, Guinée-
Bissau, Inde, Indonésie, Iran (sud), Libéria, Madagascar, Malaisie, Mali, Mauritanie, Namibie, Népal, Niger, Oman, Pakistan, Philippines, Sénégal, Sierra Léone, Somalie, Sri Lanka, Tchad, Togo, Yemen.
Groupe 3 : Angola, Bangladesh, Birmanie, Bolivie (nord), Brésil (Amazonie), Burundi, Cambodge, Cameroun (sud), Chine (Yunnan et Haïnan), Colombie, Comores, Congo, Côte d'Ivoire, Djibouti,
Equateur, Erythrée, Ethiopie, Gabon, Guinée équatoriale, Guyana, Guyane française, Iles salomon, Indonésie, Kenya, Laos, Malawi, Mayotte, Mozambique, Myanmar, Nigéria (sud), sao Tomé et Principe,
Ouganda, Panama (sud), Papouasie-Nouvelle-Guinée, Pérou (est), République Centrafricaine, Rwanda, Soudan, Surinam, Swazilland, Tanzanie, Thaïlande (zones frontalières), Vanuatu, Vénézuela,
Vietnam, Zaïre, Zambie, Zimbabwe.
Références : [1] Baird JK. N Engl J Med 2005 14; 352(15): 1565-77. [2] Salako LA et al. Afr J Med Med Sci 1984; 13(3-4): 177-82. [3] Chiluba EM et al. Afr J Med Med Sci 1987; 16(1): 43-6).
[4] Sirsat RA et al. Nephron 1997; 75(1): 108. [5] Tattersall JE et al. Clin Nephrol 1987; 28(2): 104. [6] Spencer CM et al. Drugs 1995; 50(1): 176-96. [7] Crevoisier CA et al Antimicrob Agents
Chemother 1995; 39(8): 1892-5. [8] Houin G et al Br J Clin Pharmacol 1983; 16(3): 245-252.
I C A R
- T é l . 0 1 4 2 1 7 7 2 3 0 - F a x 0 1 4 2 1 7 7 2 1 2 - E - m a i l i c a r . n e p h r o @ p s l . a p h p . f r
La diffusion de ce service est assurée avec le soutien du Laboratoire Roche. La rédaction de la Lettre d’ICAR et les recherches bibliographiques
sont effectuées sous la seule responsabilité du Conseil Scientifique et des Coordinateurs d’ICAR. Le Laboratoire Roche n’est intervenu en aucune
façon sur le contenu de la Lettre d’ICAR.
1
/
1
100%