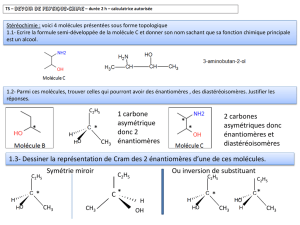
Les dérivés chlorés sont, entre autres, très utilisés comme

Les dérivés chlorés sont, entre autres, très utilisés comme intermédiaires de synthèse et solvants. Ils doivent être
synthétisés industriellement.
Le 2-méthylpropan-2-ol réagit avec l’acide chlorhydrique pour donner du 2-chloro-2-méthylpropane et de l’eau.
Q1. Donner la formule semi développée puis topologique des deux molécules en gras dans le texte.
Q2. Donner tous les isomères de l’alcool et nommez-les. (Uniquement les alcools)
Q3. Entourer le groupe fonctionnel de l’alcool et donner sa classe.
Q4. Ecrire l’équation de la réaction modélisant cette transformation en utilisant les formules brutes.
Q5. Ecrire l’équation de la réaction modélisant cette transformation en utilisant la représentation de Lewis.
Q6. Les modifications observées sont-elles des modifications de chaines ou de groupe caractéristique ?
Q7. A quelle catégorie appartient cette réaction ?
Q8. Identifier les sites donneurs et accepteurs de doublets d’électrons dans les réactifs en justifiant précisément.
Q9. Représenter par des flèches courbes le mouvement des doublets d’électrons permettant d’expliquer la
formation et la rupture des liaisons.
Partie expérimentale
Voici le protocole suivi :
Synthèse
- Dans un erlenmeyer contenant un barreau aimanté, introduire 30 mL de solutions concentrée d’acide
chlorhydrique à 11mol.L-1, puis 15,0mL de 2-méthylpropan-2-ol.
- Adapter un condenseur à air à l’erlenmeyer et placer l’ensemble sur un agitateur magnétique en fixant
l’erlenmeyer à un support vertical. Agiter pendant 20 minutes.
Purification
- Retirer le barreau aimanté, puis transvaser avec précaution le mélange dans une ampoule à décanter.
Identifier la phase aqueuse et l’évacuer.
- Ajouter à la phase organique 25mL de solution concentrée d’hydrogénocarbonate de sodium
(Na+
(aq) ; HCO3
-
(aq)). Lorsque le dégagement gazeux cesse, boucher l’ampoule, agiter en dégazant puis évacuer
la phase aqueuse.
- Ajouter à la phase organique 10mL d’eau distillée comme précédemment, laisser décanter et évacuer la
phase aqueuse.
- Introduire deux spatules de sulfate de magnésium anhydre dans la phase organique.
- Filtrer dans un erlenmeyer sec préalablement pesé.
Q10. Rechercher sur internet les phrases de risques et de sécurité et/ou les pictogrammes des réactifs utilisés.
Expliquer comment doit s’équiper l’expérimentateur.

Q11. Calculer les quantités de matière initiales des réactifs, dresser un tableau d’évolution, déterminer l’avancement
maximal xmax et indiquer quel réactif est limitant.
Q12. Quel est l’intérêt d’utiliser un excès d’acide chlorhydrique ?
Q13. Quel est l’intérêt de ce dispositif expérimental ? Faire le schéma du montage utilisé.
Q14. L’ion hydrogénocarbonate réagit avec les ions hydrogène H+
(aq) pour donner du dioxyde de carbone et de l’eau.
Ecrire l’équation de la réaction.
Q15. Schématiser l’ampoule à décanter juste après introduction de l’hydrogénocarbonate de sodium et préciser, en
justifiant, la position et la composition des deux phases.
Le sulfate de magnésium anhydre permet de sécher la phase organique grâce à la réaction d’équation :
MgSO4(s) + 7 H2O(l) MgSO4 , 7H2O(s)
Q16. En quoi consiste le séchage de cette phase et à quel moment considère-t-on que le sulfate de magnésium
anhydre est introduit en quantité suffisante?
Q17. Sachant qu’on obtient 11,6g de 2-chloro-2-méthylpropane, déterminer le rendement de la synthèse.
Q18. Citer plusieurs techniques qui permettraient de vérifier la nature du produit obtenu.
Le composé organique obtenu ainsi que l’alcool de départ sont analysés par spectroscopie infra-rouge en phase
liquide. Les deux spectres sont donnés en annexe 4. On donne également une frise des bandes d’absorption IR de
quelques liaisons caractéristiques.
Q19. Retrouver le spectre de chacune des molécules et justifier soigneusement.
Q20. Les molécules de 2-méthylpropan-2-ol sont-elles liées par des liaisons hydrogène ?
Q bonus : Expliquer pourquoi le 2- méthylpropan-2-ol est faiblement soluble dans l’eau alors que le 2-chloro-2-
méthylpropane y est insoluble.
Annexe 1 : Electronégativités : H :2,2 ; C :2,5 ; O :3,4 ; N :3,0
Annexe 2 : Tableau de données utiles :
2- méthylpropan-2-
ol
2-chloro-2-
méthylpropane
Densité
0.781
0.836
Température
d’ébullition (1 bar)
83 °C
51 °C
Solubilité dans l'eau
faible
Nulle (très faible)

Annexe 3 : Données spectrales
Annexe 4 : Spectre infrarouges
Spectre A
Spectre B

Le benzoate d’éthyle est un ester. C’est un liquide incolore presque insoluble dans l'eau, mais qui se dissout bien
dans des solvants organiques. Comme de nombreux esters volatils, il a un parfum agréable. C'est l'un des principaux
esters responsable du parfum de la cerise, et est donc utilisé en parfumerie ou en agro-alimentaire.
La saponification du benzoate d’éthyle C6H5CO2C2H5 donne des ions benzoate C6H5CO2
- et de l’éthanol par une
réaction totale.
Q1. Ecrire l’équation de la réaction modélisant la transformation.
Q2. Au niveau microscopique, la réaction se déroule en 3 étapes élémentaires dont la première est représentée ci-
dessous :
C
CH
CH
CH
CH
CH
CO
O
CH2CH3+O-
HC
CH
CH
CH
CH
CH
COCH2CH3
O-
OH
a) De quel type de réaction s’agit-il ? (reformage, craquage, polymérisation, substitution, addition ou élimination)
b) En complétant l’équation avec les doublets non liants et les polarisations de liaisons, déterminer les sites
donneurs et accepteurs d’électrons dans chaque molécule.
c) Utiliser des flèches courbes pour représenter le mouvement de doublets mis en jeu lors de la modification des
liaisons.
Les caractéristiques physico-chimiques des réactifs employés sont résumées dans le tableau suivant :
Substances
chimiques
Phrases danger et prudence et
pictogramme
Masse Molaire,
données
Hydroxyde de sodium
NaOH
H314 : provoque de graves brûlures de la peau et
des lésions oculaires
M = 40,0 g.mol-1
Benzoate d’éthyle
C6H5CO2C2H5
H226 : provoque une irritation cutanée
H319 : provoque une sévère irritation des yeux
M = 150,0 g.mol-1
Téb = 212 °C
d = 1,05
Q3. Quelles précautions expérimentales doit-on respecter pour manipuler ces composés en toute sécurité ?
Protocole expérimental :
« Dans un ballon, introduire V1 = 5,0 mL de benzoate d’éthyle et V2 = 25 mL de solution aqueuse d’hydroxyde de
sodium Na+ (aq), OH- (aq) à c2 = 4,0 mol.L-1. Chauffer à reflux jusqu’à disparition de la phase surnageante. Baisser
ensuite le support et laisser le ballon refroidir d’abord à l’air libre puis dans un bain d’eau froide. Retirer le ballon du
montage et verser son contenu dans un erlenmeyer plongé dans un bain eau-glace (sans la pierre ponce). Ajouter
progressivement en agitant avec une baguette de verre une solution d’acide chlorhydrique à c = 4,0 mol.L-1 jusqu’à
pH
1. Filtrer sous pression réduite le solide formé et le rincer à l’eau distillée froide. Récupérer les cristaux, les
sécher à l’étuve et les peser. »

Q4. Justifier la présence de deux phases en début de réaction. Que contient la « phase surnageante » ?
Q5. Etablir le tableau d’évolution du système et déterminer l’avancement maximal et le réactif limitant.
Q6. Pourquoi cette phase disparaît-elle en fin de réaction ?
Q7. Faire le schéma du chauffage à reflux.
Q8. Pourquoi doit-on attendre le refroidissement du milieu réactionnel avant de débrancher le réfrigérant ?
Q9. L’ajout d’acide chlorhydrique permet de transformer les ions benzoate en acide benzoïque. Quel est l’intérêt de
cette étape ? Ecrire l’équation correspondante.
Q10. On récupère m = 3,05 g d’acide benzoïque. Quel est le rendement de la réaction ?
Q11. On réalise les spectres RMN de l’ester et de l’acide carboxylique. Les identifier.
Q12. Rédiger un protocole permettant d’identifier le composé obtenu par CCM (éluant : cyclohexane – propanone
2/1).
Q13. Quelle autre méthode d’identification aurait-on pu utiliser ?
Acide benzoïque
Benzoate d’éthyle
Ions benzoate
Ethanol
Solubilité dans l'eau
Assez faible
Quasi nulle
Très soluble
Totale
1H
2H
3H
 6
6
 7
7
 8
8
 9
9
1
/
9
100%