Suivi temporel d`une transformation chimique par spectrophotométrie

TP C7
Suivi temporel d'une transformation
chimique par spectrophotométrie
Objectifs:
Etudier la cinétique d'une réaction, savoir utiliser.un spectrophotomètre et vérifier la loi de Beer-Lambert.
Les questions où figure le symbole ↸
↸↸
↸ sont à faire avant le TP.
↸
↸↸
↸ I. Principe de fonctionnement d’un spectrophotomètre
• Toute espèce chimique à l’état liquide ou en solution peut absorber la lumière. Par exemple, une
solution aqueuse de diode absorbe préférentiellement les radiations lumineuses dont la longueur d'onde
est proche de λ = 470nm. Ce qui lui donne sa coloration orangé à brun.
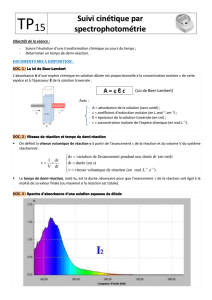
• Le spectrophotomètre permet de mesurer l’absorbance A d’une espèce dissoute.
Le bouton 'sélecteur' permet de choisir
parmi 6 D.E.L. la longueur d'onde utilisée.
Le faisceau lumineux émis par la diode
choisie traverse la partie inférieure de la
cuve contenant la solution à étudier:
une photorésistance, placée derrière la cuve,
permet de mesurer le flux lumineux φ
φφ
φ
transmis par le milieu absorbant;
un dispositif électronique relié à une entrée
d'ORPHY lui fournit une tension U
proportionnelle au flux lumineux φ
φφ
φ reçu.
L'absorbance est définie par A = log
φ
φ
0
.
1) Quelle est la valeur de A si la solution laisse totalement passer le flux lumineux incident?
2) Quelle est la valeur de A si la solution absorbe la moitié du flux lumineux incident?
Pour calculer A, on utilise le fait que la tension mesurée par ORPHY est proportionnelle au flux lumineux
transmis ainsi A = log
U
U
0
.
Où U
0
est la tension mesurée pour le flux lumineux transmis par le solvant.
Φ
ΦΦ
Φ
Φ
ΦΦ
Φ
0
D.E.L photorésistance
+ dispositif
électronique
cuve

II. Vérification de la loi de Beer-Lambert
• La loi de Beer-Lambert indique que l’absorbance A d’une solution est proportionnelle à la
concentration C de l'espèce chimique absorbant la lumière d'une longueur d’onde donnée et pour des
cuves identiques. Pour vérifier cette loi, on va mesurer l’absorbance de différentes solutions aqueuses
de diiode de concentrations apportées C connues.
a) Préparation de solutions de diiode:
• Le diiode est peu soluble dans l'eau, il se dissout mieux dans une solution aqueuse d'iodure de
potassium qui sert donc de solvant de I
2
.
• On dispose d’une solution mère de diiode de concentration apportée C
0
= 1,0.10
−2
mol.L
-1
et l’on désire
préparer 5 solutions filles, de volume V
f
= 50,0 mL.
↸
↸↸
↸ 1) Exprimer V
0
en fonction de C
0
, V
f
et C. Justifier.
↸
↸↸
↸ 2) Compléter le tableau:
V
0
(en mL)
C (en mol.L
−
1
) 5,0.10
–4
1,0.10
–3
1,4.10
–3
1,6.10
–3
2,0.10
–3
Préparer les solutions à l'aide d'une burette et de fioles jaugées.
b) Mesures d'absorbance:
- Allumer l'interface ORPHY, relier le module PHOTOCOLOR à l'interface (prise B ou C),
- Relier le voltmètre aux bornes de sortie du module PHOTOCOLOR,
- Lancer Regressi, Fichier>Nouveau>Clavier, puis indiquer les variables expérimentales qui sont :
C concentration apportée en diiode et U tension mesurée aux bornes du spectrophotomètre.
- Enregistrement du "blanc": placer une cuve remplie au 2/3 d’eau distillée, fermer le volet d'occultation.
Patienter 30 secondes puis noter la valeur de U notée U
0
qui correspond à C = 0.
- Remplir aux 2/3 les cuves avec les différentes solutions filles de diiode.
- Placer successivement chaque cuve dans l'appareil, fermer le volet d'occultation, attendre quelques
instants la stabilisation de la mesure courante, puis reporter les valeurs de U et de C dans Regressi.
- Rincer les cuves, verser les solutions filles de diiode dans le bidon de recyclage à la paillasse centrale.
c) Exploitation des mesures:
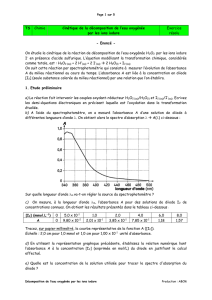
Afficher la courbe U = f(C).
Créer une nouvelle grandeur A = log
U
U
0
. (en remplaçant U
0
par sa valeur numérique)
Afficher la courbe A = g(C). Modéliser en entrant manuellement le modèle mathématique.
Noter les résultats de la modélisation : - modèle mathématique choisi
- valeur de la constante k de proportionnalité
- la valeur de l’écart expérience-modèle.
(L'écart doit être le plus faible possible et le coefficient de corrélation doit être proche de 1)
Imprimer le graphe, le tableau de valeurs et la modélisation
Cette valeur de k est nécessaire au bon déroulement du suivi cinétique qui va suivre.

III. Suivi d’une cinétique:
Objectifs :
• Mesurer sur une longue durée l'absorbance d'une solution à partir de mesures de flux lumineux
utilisant un spectrophotomètre.
• S’en servir pour suivre l’évolution au cours du temps de la concentration C d’un produit lors d’une
transformation lente.
• Représenter graphiquement les résultats précédents sous la forme x= f(t) pour visualiser l’évolution
temporelle de la transformation
.
a) Manipulation:
Relier la borne – de PHOTOCOLOR à l'entrée 0 V du module GTS
et relier l'autre sortie à l'entrée EA6.
La DEL utilisée reste celle à λ = 470 nm.
Ouvrir le logiciel GTS.
Choix du mode d'acquisition:
Cliquer dans la fenêtre Mode. Choisir le mode temporel.
Choix du mode de déclenchement de l'acquisition:
Cliquer dans la fenêtre Synchronisation. Choisir Clavier.
Choix de la durée d'acquisition et du nombre de mesures:
Dans la zone Balayage. Indiquer: Durée = 0 : 15 :00 et Nombre = 90
L'acquisition durera 15 min et l'ordinateur fera 90 mesures de U.
Choix de la voie d’acquisition:
Cliquer dans la partie inférieure droite de l'écran.
Choisir comme entrée analogique EA6 prise C puis +/- 200mV, cocher V > 0.
Symbole de la grandeur U et unité V
Signe de la tension : positive Capteurs: Sans.
Désactiver les autres voies.
BIEN LIRE TOUT CE PARAGRAPHE AVANT DE FAIRE LA MANIPULATION
Placer V
1
= 10,0 mL d’une solution d’eau oxygénée de concentration apportée c
1
= 1,0.10
–2
mol.L
–1
dans un becher.
Dans un autre becher, introduire V
2
= 10,0 mL d’une solution d’iodure de potassium (acidifiée) de
concentration apportée c
2
= 0,25 mol.L
–1
.
Placer un peu de solution d’iodure de potassium acidifiée dans une cuve, dans le colorimètre : c'est la
mesure de référence C = 0 qui sera acquise à t = 0.
Mélanger rapidement le contenu des deux bechers et cliquer sur ( on est alors à t = 0).
Remplir une autre cuve au 2/3 de mélange réactionnel bien homogénéiser et remplacer la cuve de
référence le plus rapidement possible (avant t = 10 s si possible)
Les prises de mesures sont effectuées automatiquement par le logiciel pour toute la durée choisie ; la
partie du mélange réactionnel conservée à l'extérieur de l'appareil de mesure permet de suivre
qualitativement l'apparition du diiode.

↸ b) Étude théorique:
On étudie la réaction entre les ions iodure et le peroxyde d'hydrogène (eau oxygénée)
1) Écrire l’équation de la réaction d'oxydoréduction. (1/2 équations exigées)
Couples mis en jeu : H
2
O
2
(aq)
/ H
2
O
(l)
I
2(aq)
/ I
–(aq)
2) La solution d'iodure de potassium utilisée est acidifiée avec de l'acide sulfurique. Justifier cet
ajout.
3) Compléter le tableau d’avancement de la transformation étudiée, justifier la valeur de x
max
.
On considère que H
+(aq)
n'est pas réactif limitant.
équation chimique
État du système Avancement
Quantités de matière (en
m
mol)
État initial x = 0 n
1
= 0,10 n
2
= 2,5
excès beaucoup
(solvant)
État intermédiaire
(en fonction de x) excès beaucoup
État final
(littéral en
fonction de x
max
) excès beaucoup
État final
valeurs en mmol
si totale
excès beaucoup
4) Donner la relation entre la concentration en diiode à un instant t et la valeur x(t) à cet instant.
5) En déduire la relation entre l’absorbance A(t) à un instant t et l’avancement de la réaction x(t). (utiliser
la loi de Beer Lambert et la valeur de la constante k déterminée au I))
c) Exploitation des mesures:
Transférer les données acquises par GTI dans Regressi.
Créer une nouvelle grandeur calculée A = log(U
0
/U) où U
0
est la valeur numérique de la tension de
référence (première valeur à t = 0)
Créer encore une nouvelle grandeur calculée : x = (expression trouvée par vos soins question 5
précédente).
Obtenir le graphe, x = f (t). Appliquer un fort lissage à la courbe: clic droit Coordonnées.
1) Comment évolue la vitesse volumique de réaction au cours du temps ? Justifier. Donner une explication
de cette évolution.
2) Relever la valeur de x
final
.
3) Peut-on affirmer que la transformation est limitée ? Justifier.
4) À l'aide de l'outil réticule déterminer le temps de demi-réaction t
1/2
. Expliquer la démarche.

0,75
0,5
0,25
0,5
0,5
0,5
0,5
0,5
0,5
0,5
TP C7
CORRECTION
barème /17,5
Suivi temporel d'une transformation
chimique par spectrophotométrie
I. Principe de fonctionnement d’un spectrophotomètre /1,25 pt
1) Si la solution n'absorbe pas de lumière alors φ (transmis) = φ
0
(incident), donc A = log 1 = 0
2) Si φ = φ
0
/2, alors A = log 2/
0
0
φ
φ
= log 2 = 0,30
II. Vérification de la loi de Beer-Lambert / 5,75 pts
a) Préparation de solutions de diiode:
1) solution mère: solutions filles:
C
0
= 1,0.10
–2
mol.L
–1
C
V
0
mL à prélever V
f
= 50,0 mL
Au cours de la dilution, la quantité de diiode se conserve, donc C
0
.V
0
= C .V
f
soit V
0
=
0
.
C
VC
f
,
ou V
0
=
2
C 50,0
1,0.10
−
×
V
0
= 5,0×
××
×10
3
.C
avec V
0
exprimé en mL et C en mol.L
–1
2)
V
0
(en mL)
2,5 5,0 7,0 8,0 10
C (en mol.L
−
1
) 5,0.10
–4
1,0.10
–3
1,4.10
–3
1,6.10
–3
2,0.10
–4
c) Exploitation des mesures:
modèle mathématique
choisi : fonction linéaire
A = k.C
résultat de la
modélisation :
A = 245 C
avec C en mol.L
–1
écart modèle-expérience :
9%
(doit être le plus
petit possible)
III. Suivi d’une cinétique: / 10,5 pts
b) Étude théorique:
1)
couple I
2
/ I
–
: oxydation des ions iodure 2I
–(aq)
= I
2 (aq)
+ 2 e
–
couple H
2
O
2
/ H
2
O: réduction de eau oxygénée H
2
O
2(aq)
+ 2e
–
+ 2H
+(aq)
= 2H
2
O
(
l
)
H
2
O
2(aq)
+ 2I
–(aq)
+ 2 H
+(aq)
= I
2 (aq)
+ 2H
2
O
(
l
)
2)
L'équation de la réaction indique que l'ion hydrogène est un réactif, l'acide sulfurique apporte
ces ions H
+(aq)
.
Graphe + titre :
1
tableau de valeurs:
0,5
modélisation:
0,5
écart < 10%:
0,5
Absorbance de solutions de
diiode en fonction de leur
concentration molaire
0,5
0,5
0,5
 6
6
1
/
6
100%