Cours - PhyZik

A3
Matières colorées
Comment la chimie peut-elle nous aider pour comprendre et analyser le caractère coloré de la matière ou d’une
substance ? Nous devrons aussi apprendre à décrire l’évolution d’un système chimique.
I – Pigments et colorants
Activité p 74 – ppt colorants et pigments
Les pigments sont des substances finement divisées et insolubles dans le milieu qui les contient. A l’opposé, les
colorants y sont solubles.
Ex 1,5 p 80
II – Extraction et identification de matières colorées
Activité – Extraction des colorants des M&M’s
Extraction : Le matériau contenant les espèces chimiques colorées est plongé dans un solvant qui les dissout.
Identification : La chromatographie permet de séparer les différents constituants du mélange de colorants puis de
les identifier par comparaison des rapports frontaux Rf.
Ex 13,16 p 82
Activité – Synthèse d’une matière colorée (Indigo)
III – Réaction chimique
1) Equation d’une réaction chimique
Matériel pour la réaction suivante :
Dans le bécher 1 : décoloration totale de la solution
de diiode. Le thiosulfate de sodium a consommé tout
le diiode qui a été versé en défaut.
Dans le bécher 2 : le diiode n’est pas totalement
consommé. Il a été versé en excès.
Dans le bécher 2 :
État initial
Transformation chimique
État final
Eau
Diiode
Thiosulfate de sodium
Eau
Diiode et ions iodure
Ions tétrathionate
et sodium
Réactifs : et
Produits : et
Equation de la réaction chimique : Réactifs Produits
Dans l’équation d’une réaction chimique, il faut respecter la conservation de la charge et des atomes à l’aide des
coefficients stœchiométriques.
Ex :
Bécher 1
Bécher 2
40 mL et C = 10-2mol.L-1
de thiosulfate de
sodium (
)
10 mL et C = 10-2mol.L-1
de diiode
25 mL et C = 10-2mol.L-1
de diiode

2) Interprétation de la réaction à l’aide de l’équation
a) Evolution du système chimique
Matériel pour la réaction suivante :
Coloration lente due à l’apparition de diiode .
L’intensité de la coloration rend compte de l’évolution de la réaction :
Les réactifs disparaissent et les produits apparaissent en respectant la
stœchiométrie de la réaction :
x mol de
réagissent avec 2x mol d’ pour donner x mol de et 2x
mol de
.
b) Bilan de quantité de matière
L’évolution de la réaction peut être décrite dans un tableau d’avancement :
Etat
avancement
Quantités de matière (mol)
initial
0
0,1 0,2
0 0
en cours
x
final
0 0
0,1 0,2
x est l’avancement et est exprimé en mol. Il permet de décrire l’évolution de la réaction.
Quand la réaction est-elle terminée ?
Quand l’un des réactifs a disparu :
Si
alors soit
Si alors soit
L’avancement maximal est .
Ici, tous les réactifs ont été consommés, car ils étaient en proportions stœchiométriques.
Nous dirons que 0,1 mol de
réagissent avec 0,2 mol d’ pour donner 0,1 mol de et 0,2 mol de
.
Remarque importante : Seuls des nombres de moles doivent figurer dans un tableau d’avancement. L est possible de
les déterminer si nécessaire à l’aide des formules suivantes :
, et
pour les gaz.
Poly d’exemples avec des tableaux à remplir
c) Cas des mélanges non-stœchiométriques
En général, les quantités de matière initiales des réactifs ne correspondent pas aux coefficients stœchiométriques.
Exemple :
Etat
avancement
Quantités de matière (mol)
initial
0
0,1 0,4
0 0
en cours
final
0 0,2
0,1 0,2
Si
a été entièrement consommé :
=>
Si c’est qui a été entièrement consommé :
=>
40 mL et C = 10-2mol.L-1 de
peroxodisulfate de
potassium (
)
10 mL et C = 10-2mol.L-1 d’iodure
de potassium ( )

La valeur maximale qui peut être atteinte par l’avancement es et l’état final est complété avec
cette valeur de
Nous dirons que :
est le réactif en excès et
est le réactif en défaut.
Poly d’exemples de mélanges non-stœchiométriques
IV – Absorbance d’une solution colorée
1) Définition
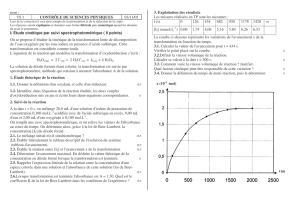
Expérience : Spectre d’absorption d’une solution de KMnO4 à deux concentrations différentes et une de CuSO4
Une solution colorée absorbe certaines radiations de la lumière blanche. Le spectre obtenu est son spectre
d’absorption.
L’absorbance notée A est la proportion de lumière absorbée par une solution à une longueur d’onde λ donnée.
Elle dépend également de la concentration de la solution.
Loi de Beer-Lambert : A = k.C pour une longueur d’onde donnée
avec A absorbance sans unité
C en mol.L-1
Ex 7,8 p 95
2) Mesure
On utilise un spectrophotomètre qui permet de mesurer
l’absorbance A d’une solution.
Exemple : Spectre d’absorption d’une solution de permanganate
de potassium: A = f(λ)
Pour réaliser des mesures d’absorbance, le spectrophotomètre
et réglé sur la longueur d’onde λmax correspondant au maximum
d’absorption de la solution étudiée.
Pour le spectre précédent : λmax = 540 nm.
Nous pouvons alors mesurer l’absorbance en fonction de la
concentration de la solution A = f(C)
Ex 10,11 p 81
Ex 11 p 95
3) Application au dosage
Activité - Dosage du Dakin
Doser une espèce chimique en solution consiste à déterminer sa concentration C. Si elle est colorée, nous pouvons
effectuer un dosage spectrophotométrique par étalonnage.
1
/
3
100%