Document

Page 1 sur 5
Décomposition de l’eau oxygénée par les ions iodure Production : ABCM
TS
Chimie
Cinétique de la décomposition de l’eau oxygénée
par les ions iodure
Exercice
résolu
- Enoncé -
On étudie la cinétique de la réaction de décomposition de l’eau oxygénée H2O2 par les ions iodure
I- en présence d’acide sulfurique. L’équation modélisant la transformation chimique, considérée
comme totale, est : H2O2 (aq) + 2 H+(aq) + 2 I-(aq) 2 H2O(l) + I2 (aq)
On suit cette réaction par spectrophotométrie qui consiste à mesurer l’évolution de l’absorbance
A du milieu réactionnel au cours du temps. L’absorbance A est liée à la concentration en diiode
[I2] (seule substance colorée du milieu réactionnel) par une relation que l’on établira.
1. Etude préliminaire
a) La réaction fait intervenir les couples oxydant-réducteur H2O2 (aq)/H2O(l) et I2 (aq)/I-(aq). Ecrivez
les demi-équations électroniques en précisant laquelle est l’oxydation dans la transformation
étudiée.
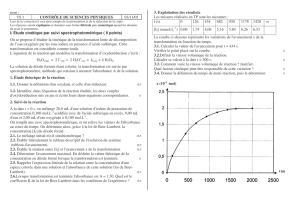
b) A l’aide du spectrophotomètre, on a mesuré l’absorbance A d’une solution de diiode à
différentes longueurs d’onde . On obtient alors le spectre d’absorption A() ci-dessous :
Sur quelle longueur d’onde m va-t-on régler la source du spectrophotomètre ?
c) On mesure, à la longueur d’onde m, l’absorbance A pour des solutions de diiode I2 de
concentrations connues. On obtient les résultats présentés dans le tableau ci-dessous :
[I2] (mmol.L-1)
0
5,0 x 10-1
1,0
2,0
4,0
6,0
8,0
A
0
9,80 x 10-2
2,01 x 10-1
3,85 x 10-1
7,85 x 10-1
1,18
1,57
Tracez, sur papier millimétré, la courbe représentative de la fonction A ([I2]).
Echelle : 2,0 cm pour 1,0 mmol et 1,0 cm pour 1,00 x 10-1 unité d’absorbance.
d) En utilisant la représentation graphique précédente, établissez la relation numérique liant
l’absorbance A à la concentration [I2] (exprimée en mol/L) du diiode en justifiant le calcul
effectué.
e) Quelle est la concentration de la solution utilisée pour tracer le spectre d'absorption du
diiode ?

Page 2 sur 5
Décomposition de l’eau oxygénée par les ions iodure Production : ABCM
2. Préparation des solutions
a) On dispose d’une solution mère S0 d’eau oxygénée de concentration C0 = 1,0 mol.L-1 en soluté
apporté. Calculez le volume V0 de solution S0 à prélever pour fabriquer un volume V = 50 mL d’une
solution S d’eau oxygénée de concentration C = 5,0 x 10-2 mol.L-1 en soluté apporté.
b) Calculez la masse m d’iodure de potassium KI solide à peser pour fabriquer une solution S’
d’iodure de potassium, de volume V' = 10mL, de concentration C’ = 6,0 x 10-2 mol.L-1 en soluté
apporté (masse molaire de l’iodure de potassium : M = 166 g.mol-1).
3. Conditions expérimentales
On place dans la cuve du spectrophotomètre un volume v = 1,0 mL de la solution S d’eau oxygénée.
A la date t = 0, on ajoute un volume v’ = 1,0 mL de la solution acidifiée S’ d’iodure de potassium
(l’acide est en excès).
a) Complétez numériquement, en annexe (1), les deux premières lignes du tableau descriptif de
l’évolution du système soit x l’avancement).
b) Quel est le réactif qui limite cette réaction ? Complétez la dernière ligne du tableau en
justifiant votre réponse.
c) Calculez la valeur finale [I2]f de la concentration en diiode à la fin de la réaction.
4. Etude cinétique
On lance la mesure de l’absorbance en fonction du temps en effectuant une mesure toutes les
secondes. On obtient l’enregistrement reproduit en annexe (2).
a) Définissez la vitesse instantanée volumique V(t) de la réaction à une date t quelconque.
b) Quelle relation existe-t-il entre l’avancement x de la réaction et la concentration molaire [I2]
en diiode ? En déduire la relation entre la vitesse V(t) et la concentration [I2], puis celle entre V(t)
et l’absorbance A.
c) Déterminez graphiquement, en mol.L-1.s-1, la vitesse instantanée V(t=50s) de formation du
diiode à la date t = 50 s. Justifiez la méthode utilisée.
d) Les vitesses instantanées V(t=10s) et V(t=150s) de formation du diiode aux dates t = 10 s et
t = 150 s ont pour valeurs respectives :
V(t=10s) = 2,5 x 10-4 mol.L-1.s-1 et V(t=150s) = 9,8 x 10-6 mol.L-1.s-1
Comment évolue la vitesse volumique de formation du diiode au cours du temps ? Donnez une
explication à ce phénomène.

Page 3 sur 5
Décomposition de l’eau oxygénée par les ions iodure Production : ABCM
Annexe (1) de l’exercice n°2
Réaction
H2O2 (aq) + 2 H+(aq) + 2 I-(aq) 2 H2O(l) + I2 (aq)
Date
Avancement
(µmol)
Quantité
de H2O2 (aq)
(µmol)
Quantité
de H+(aq)
(µmol)
Quantité
de I-(aq)
(µmol)
Quantité
de H2O(l)
(µmol)
Quantité
de I2(aq)
(µmol)
t = 0
Excès
Excès
t
Excès
Excès
t
Excès
Excès
Annexe (2) de l’exercice n°2

Page 4 sur 5
Décomposition de l’eau oxygénée par les ions iodure Production : ABCM
- Corrigé -
1. a) 2 H+(aq) + H2O2 (aq) + 2 e- = 2 H2O(l) et 2 I-(aq) = I2 (aq) + 2 e- (oxydation)
b) On va régler le spectrophotomètre sur m = 345 nm car c’est pour cette longueur d’onde que le
diiode absorbe le plus.
c) On trouve une droite qui passe par l’origine.
d) L’absorbance est proportionnelle à la concentration [I2] en diiode : A = k.[I2], avec k
coefficient directeur de la droite. Par détermination graphique, on trouve k = 196 L.mol-1.
La relation cherchée est donc : A = 196[I2]
e) A la longueur d’onde m = 345 nm, l’absorbance de la solution de diiode utilisée pour tracer le
spectre d’absorption est A = 0,94.
La concentration en diiode de cette solution est donc :
[I2] =
196
A
=
0,94
196
= 4,8 x 10-3 mol.L-1 ou 4,8 mmol.L-1
2. a) On trouve :
00
.CV
VC
soit V0 =
23
5,0 10 50 10
1,0
= 2,5 x 10-3 L ou 2,5 mL
b) On trouve : m = C’.M.V’ soit m = 6,0 x 10-2 x 166 x 10 x 10-3 = 1,0 x 10-1 g
3. a) et b) L’ion iodure est le réactif limitant.
Réaction
H2O2 (aq) + 2 H+(aq) + 2 I-(aq) 2 H2O(l) + I2 (aq)
Date
Avancement
(µmol)
Quantité
de H2O2 (aq)
(µmol)
Quantité
de H+(aq)
(µmol)
Quantité
de I-(aq)
(µmol)
Quantité
de H2O(l)
(µmol)
Quantité
de I2(aq)
(µmol)
t = 0
0
50
Excès
60
Excès
0
t
x
50 - x
Excès
60 – 2x
Excès
x
t
Xmax = 30
20
Excès
0
Excès
30
c)
2
2
()
'f
f
nI
Ivv
soit [I2]f =
6
3
30 10
2,0 10
= 1,5 x 10-2 mol.L-1 ou 15 mmol.L-1
4. a)
() 1.
( ')
tt
dx
Vv v dt
b) [I2] =
( ')
x
vv
=>
2
[ ].( ')x I v v
On a donc :
2
[]
( ').dI
dx vv
dt dt
=>
2
() []
tt
dI
Vdt
Or, A = k.[I2] =>
2
2[] 1
[ ] .
t
t
dI
A dA
Ik dt k dt
=>
() 1.
tt
dA
Vk dt

Page 5 sur 5
Décomposition de l’eau oxygénée par les ions iodure Production : ABCM
c) La vitesse volumique instantanée V(t=50s) de formation du diiode à la date t = 50 s est égale
au rapport du coefficient directeur de la tangente à la courbe représentative de la fonction t
A(t) au point d’abscisse t = 50 s par le coefficient k défini à la question 1.d.
On trouve V(t=50s) = 1,2 x 10-4 mol.L-1.s-1
d) La vitesse volumique de formation du diiode diminue au cours du temps.
La vitesse volumique de formation d’un produit est une fonction croissante de la concentration
des réactifs. Or, au cours du temps, la concentration des réactifs va en diminuant : donc la
vitesse volumique de formation du diiode diminue aussi.
1
/
5
100%