DESIGN DE L`ETUDE Environ 900 patients seront inclus dans cette

Etude SCOPE vian 06.12.2016
NON INTERVENTIONAL STUDY TO EVALUATE THE INFLUENCE OF THE SEQUENCE
IN WHICH CABAZITAXEL IS APPLIED ON THE OUTCOME OF PATIENTS WITH
METASTATIC CASTRATION RESISTANT PROSTATE CANCER TREATED WITH
CABAZITAXEL
“Etude SCOPE”
Sponsor : Sanofi Aventis
CONTACTS AUX HUG : Unité de recherche en Onco-Hématologie, Fondation DFDL
Coordinatrice de l’étude : Mme Delphine Gani, 079 553 24 26
Investigateur responsable: Dr Anna Patrikidou, 079 553 60 99
Secrétariat: Mme Florence Marti-Klay, 022 372 29 01
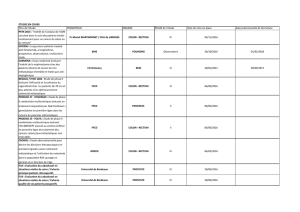
DESIGN DE L’ETUDE
Environ 900 patients seront inclus dans cette étude, dans 300 centres ouverts en
Allemagne, en Autriche et en Suisse.
Des données seront récoltées à trois reprises pendant l’étude :
Les données collectées sont :
Caractéristiques du patient
Diagnostic de la tumeur
Durée de la réponse au premier traitement par ADT
Traitement reçus avant le docetaxel
Traitement avec le docetaxel
Traitement après le docetaxel et avant le cabazitaxel
Nombre de traitements reçus avant le cabazitaxel
Traitement avec le cabazitaxel
Traitements après le cabazitaxel et réponses
Valeurs de laboratoires
Effets indésirables / sécurité
Follow Up 1:
at timepoint of
disease
progression
Inclusion/Baseline:
Start Cabazitaxel
administration
End of Study:
24 months FU after start
of treatment with
Cabazitaxel

Etude SCOPE vian 06.12.2016
OBJECTIF DE L’ETUDE
Sont évalués dans cette étude :
- L’impact des caractéristiques des patients, des caractéristiques de la tumeur
et surtout des prétraitements sur la réponse thérapeutique des patients traités
par cabazitaxel, mesuré par la durée de la survie sans progression (PFS) dès
l’administration de la première dose de cabazitaxel.
La PFS est définie par le médecin traitant à l’aide d’examens radiologiques, cliniques
ou d’analyses biochimiques.
- L’impact de la séquence thérapeutique (ordre dans lequel les traitements sont
instaurés avant et après cabazitaxel) sur la survie à 2 ans dès le début du
traitement à base de cabazitaxel.
CRITERES D’ELIGIBILITE
Critères d’inclusion :
- Patients with metastatic castration resistant prostate cancer (mCRPC) who are
planned to be treated with cabazitaxel
- Patients pretreated with docetaxel
- Written informed consent
- Patients age >18 years
Critères d’exclusion:
- Patients age <18 years
- Participation in a clinical trial and any administration of IMP until 30 days prior
to reenrollment into SCOPE Study
- Treatment with cabazitaxel prior to enrollment
1
/
2
100%