CORRECTION DS n°5 – Un peu de chimie avec le lait PARTIE A

CORRECTION DS n°5 (2h) – Chap C.2+C.3 – 30/01/2015 TS
1
RCH COOH
NH3
+RCH COO-
NH3
+RCH COO-
NH2
CORRECTION DS n°5 – Un peu de chimie avec le lait
– La calculatrice N’EST PAS autorisée –
PARTIE A : Le lait, une source importante d’acides aminés
1. La leucine présente à la fois une fonction acide carboxylique COOH et une fonction amine NH2 ,
d’où son nom « d’acide aminé ».
2.
Différentes formes de la leucine en solution aqueuse :
2.1. Un des couples acide/base correspond au groupe carboxyle, de pKa le plus faible : COOH / COO–
L’autre couple acide/base correspond au groupe amine, de pKa le plus élevé : NH3+ / NH2
On a donc les formes suivantes :
A B C
L’amphion (forme
B
) joue donc le rôle de base dans le couple
A/B
et le rôle d’acide dans le couple
B/C
: on dit que c’est une espèce ampholyte.
2.2. Diagramme de prédominance de la leucine :
2.3. Le pH d’un lait frais est égal à 6,7, on a donc pKa,1 < pHlait < pKa,2 . C’est donc l’amphion
(forme
B
) qui prédomine sur les deux autres formes dans un lait.
PARTIE B : Au sujet de l’acide lactique
1. Molécule d’acide lactique
1.1. Acide lactique : groupe carboxyle,
Fonction acide carboxylique
groupe hydroxyle,
fonction alcool
1.2. Selon Brønsted, un acide est une espèce chimique capable de donner un ion H+.
L’ion lactate, base conjuguée de l’acide lactique s’écrit donc :
(rappel : l’ion H+ donné/reçu par l’espèce acide/basique est
souvent lié à un atome O ou N)
A
prédomine
pH
14
0
2,4 = pKa 1
B
prédomine
9,6 = pKa 2
CH3CH C
OH
O
OH
CH3CH C
OH
O
O-
C
prédomine

CORRECTION DS n°5 (2h) – Chap C.2+C.3 – 30/01/2015 TS
2
2. Acide fort ou acide faible ? Énoncé :
C=1,0.10-4 mol/L et pH=4,2
2.1. Couples RCOOH /RCOO– RCOOH (aq) + H2O (ℓ) RCOO– (aq) + H3O+ (aq)
H3O+ / H2O
2.2. D’après la stœchiométrie de la réaction : 1 mol RCOOH 1 mol RCOO– + 1 mol H3O+, on peut
écrire en fin de transformation : [RCOO–]f = [H3O+]f
et [RCOOH]f = [RCOOH]0 – [RCOOH]réagi = C – [H3O+]f
Or [H3O+] = 10-pH = 10-4,2 = 0,63.10-4 mol/L
On en déduit donc que [H3O+]f < C, ce qui indique que [RCOOH]f ≠ 0 : la réaction de RCOOH
avec l’eau n’est pas totale (la réaction est limitée), RCOOH est donc un acide FAIBLE.
Autre méthode :
D’après la stœchiométrie de la r° : 1 mol RCOOH 1 mol RCOO– + 1 mol H3O+.
Donc si la réaction est totale : [H3O+]f = [RCOOH]0 [H3O+]f = C
Et on aurait donc : pH = –log[H3O+] pHTOT = –log(C) = –log(1,0.10-4) = 4,0.
Or on a pHexp=4,2, c’est à dire que pHexp > pHTOT, c’est donc la réaction de RCOOH avec l’eau n’est
pas totale (la réaction est limitée), RCOOH est donc un acide FAIBLE.
2.3. Ka =
-+
3
RCOO H O
RCOOH
=
-4 -4 -8 -8
-4 -4 -4
0,63.10 0,63.10 0,63² 10 0,40.10
0,37.10 0,37.10 0,37.10
= 1,0.10-4
avec : [H3O+] = 10-pH = 10-4,2 = 0,63.10-4 mol/L [RCOO–] = [H3O+] = 0,63.10-4 mol/L
[RCOOH] = C – [H3O+] = 1,0.10-4 – 1,0.10-4,2 = 10.10-4 – 0,63.10-4 = 0,37.10-4 mol/L
3. Espèce prédominante dans un lait frais :
3.1. Le pH d’un lait frais est égal à 6,7, on a donc pHlait > pKa . C’est donc la base du couple,
RCOO– , qui prédomine sur RCOOH dans un lait.
On pouvait ajouter un diagramme de prédominance pour justifier, mais ce n’était pas exigé.
3.2. Ka=
-+
3
RCOO H O
RCOOH
-
a
3
RCOO K
RCOOH HO
pKa 4,0
pH 6,7
10 10
10 10
= 102,7
RCOO
RCOOH
=500
On a donc [RCOO–] >> [RCOOH] : RCOO– est largement prédominante sur RCOOH, ce
qui confirme bien le résultat de la question précédente.

CORRECTION DS n°5 (2h) – Chap C.2+C.3 – 30/01/2015 TS
3
PARTIE C : Dosage pH-métrique d’une solution d’acide lactique
Énoncé :
Titrage de
Va=10 ± 0,1 mL
de
RCOOH
par
HO–
à
Cb=1,00.10-2 ± 0,01.10-2 mol/L
.
1. Équation du titrage :
1.1. Une réaction de titrage doit être totale, unique et instantanée.
1.2. Couples RCOOH /RCOO– : RCOOH (aq) + HO– (aq) RCOO– (aq) + H2O (ℓ)
H2O / HO–
titré titrant
1.3. Un titrage est une méthode
destructive
car la composition de l’échantillon étudié est modifiée
au cours de son analyse.
2. Sur le diagramme de distribution du document 1, la courbe
1
correspond à l’acide lactique RCOOH
car sa quantité diminue au cours du titrage (c’est le réactif titré), la courbe
2
correspond à l’ion
lactate RCOO– car sa quantité augmente au cours du titrage (c’est un produit de la réaction)
3. Par la méthode des tangentes parallèles on obtient : VE=10,0 mL et pHE=7,8
Or à l’équivalence, le réactif titré et le réactif titrant ont été introduits dans les proportions
stœchiométriques de l’équation du titrage.
E
dosé n
n
11
HO
RCOOH
On en déduit: Ca×Va,dosé = Cb×Vb,E Ca=
b b,E
a,dosé
CV
V
2
1,00.10 10,0
10,0
= 1,00.10-2 mol/L
4.
a b a
E
a b E a
C C V
V
C C V V
ba
E
aa
b E a
CV
V
CC C V V
=
2
20,01.10
1,00.10
2
1,00.10
0,1 0,1
10,0 10,0
=
2 2 2 2
1,00.10 10 10 10
=
22
1,00.10 3 10
=
2
1,00.10 0,2
Ca = 0,2.10-2 mol/L
Ainsi : Ca = 1,0.10-2 ± 0,2.10-2 mol/L ou encore Ca = (1,0 ± 0,2)×10-2 mol/L
5. Pour ce titrage on aurait choisi le rouge de crésol, car c’est l’indicateur dont la zone de virage
encadre le mieux le pH à l’équivalence (pHE=7,8). À l’équivalence on aurait observé un passage
du jaune au rouge de la solution titrée, car celle-ci passe d’un état acide (pH faible) à basique
(pH élevé).

CORRECTION DS n°5 (2h) – Chap C.2+C.3 – 30/01/2015 TS
4
PARTIE D : Dosage conducti. de l’acide lactique dans un lait
Énoncé :
Titrage de
Va=100 mL
de
RCOOH
par
HO–
à
Cb=0,100 mol/L
.
Équation du titrage :
RCOOH (aq) + HO– (aq) RCOO– (aq) + H2O (ℓ)
(voir partie précédente)
1. Interprétation de l’allure de la courbe de titrage :
1.1. D’après la loi de Kohlrausch, à tout stade du dosage :
= RCOO-×[RCOO–] + HO-×[HO–] + Na+×[Na+]
(RCOOH ne conduit pas !)
1.2. Avant E : [RCOO–] [HO–] [Na+]
augmente nulle augmente
(produit par r°) (versé et (versé sans
consommé) être consommé)
AVANT l’équivalence, la conductivité augmente
1.3. Après E : [RCOO–] [HO–] [Na+]
nulle augmente augmente
(totalement (versé sans (versé sans
consommé) être consommé) être consommé)
APRÈS l’équivalence, la conductivité augmente
1.4. La conductivité augmente avant et après l’équivalence, mais étant donné que RCOO–< HO– :
l’ion HO– fait davantage augmenter la conductivité APRÈS l’équivalence que RCOO– ne fait
augmenter la conductivité AVANT ’équivalence, ce qui explique que la conductivité augmente
davantage APRÈS l’équivalence qu’AVANT.
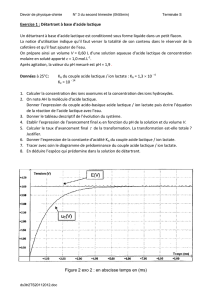
2. Détermination du degré Dornic du lait :
2.1. Graphiquement (voir Annexe), en modélisant par 2 portions de droite VE=10,0 mL
Dans la question C–3 on a démontré : Ca=
b b,E
a,dosé
CV
V
Ce qui donne ici : Ca =
0,100 10,0
100
=
1,00
100
= 1,00.10-2 mol/L
2.2. On a donc n=1,00.10-2 mol d’acide lactique par litre de lait,
soit une masse m = n×M = 1,00.10-2×90,0 = 90,0×10-2 = 0,900 g d’acide lactique par litre de lait.
D’après la définition du degré Dornic, ce résultat correspond donc à 9,00 °D, ce qui est bien
inférieur à 18 °D, le lait est donc frais.

CORRECTION DS n°5 (2h) – Chap C.2+C.3 – 30/01/2015 TS
5
ANNEXES
Document 1
Document 2
2 4 6 8 10 12 14 16 18
Vb (mL)
50
100
150
200
250
300
350
400
450
σ (µS/cm)
Titrage par conductimétrie de l'acide lactique d'un lait par une solution d'hydoxyde de sodium
pHE
E
Courbe 1
Courbe 2
Vb (mL)
pH
% des
espèces
VE
Vb (mL)
1
/
5
100%