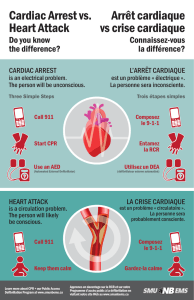
sideration myocardique neurogenique dans la sclerose en plaques

http://portaildoc.univ-lyon1.fr
Creative commons : Paternité - Pas d’Utilisation Commerciale -
Pas de Modification 2.0 France (CC BY-NC-ND 2.0)
http://creativecommons.org/licenses/by-nc-nd/2.0/fr
BERNARD
(CC BY-NC-ND 2.0)

!"#$%&'#(%)*+,!-%).%&",&-)/)+01")2)
3,*!+(%)-%)4%-%*#"%)+01")%'()
,""%%))5627))))))))))))))"859)
)
)
)
)
)
)
)
)
)
!"#$#%
)
:;<=>?@<>)A)&'()*+,-.*/0%1&234,%5,-)2-4%678)%9)
>@)=BC@>?C>)DCEFGHC>I>?@)F>):;%<0+-*,-%:=9>)
DBC;)BE@>?G;)F>)J;KL>)L>)-BM@>C;)>?)4<L>MG?>)
)
:K;)
)
#?*&*,)%5#@AB@C%
)
"<)F>)22)=>D@>IE;>)2NO7)
A)+KPBC)
)
)
)
)
)
$DC#@B!DEA%FGE1B@CDH(#%A#(@EI#ADH(#%
CBA$%6B%$16#@E$#%#A%J6BH(#$%
BERNARD
(CC BY-NC-ND 2.0)

KB1(6!#%C#%F#C#1DA#%6GEA%#$!%
)
6D$!#%C#$%#A$#DIABA!$%:=9LM:=9>%
)
J-8<,..,3-.%4,.%()*+,-.*/0.%N%J-2/*O*,).%"8.P*/2&*,-.%
,FFBCKMQGMQ>).>;?K;L)
,?>=@Q<=GBFBJG>R;<K?GIK@GB?S)I<L>MG?>)LTC;J>?M>)
,?L;<R3BC>@)UKVG>;))
*K;LGBFBJG>))
,;JKCL)+KC;>?@)&<K?GIK@GB?))
I<L>MG?>)LTC;J>?M>))
,CE;C?)3;<L<;GM))
,?>=@Q<=GBFBJG>R;<K?GIK@GB?S)I<L>MG?>)LTC;J>?M>))
.KL>@)+GB?>F))
!;BFBJG>))
.K;@Q)UKVG>;))
*QG;C;JG>)J<?<;KF>))
.K=@G>?)1FGVG>;))
,?>=@Q<=GBFBJG>R;<K?GIK@GB?S)I<L>MG?>)LTC;J>?M>))
.KV>;>F)WKE;G>F))
:QX=GBFBJG>))
.>;@Q>Y>?>)0V>=))
&KLGBFBJG>)>@)GIKJ>;G>)I<LGMKF>))
.>;@;K?L)0V>=))
:<LGK@;G>))
.>==>;>KC)Z>K?R+BCG=))
.GBFBJG>)M>FFCFKG;>))
.>YGK@)Z>K?R+CM))
*QG;C;JG>)IKPGFFBR[KMGKF>)>@)=@BIK@BFBJG>))
.FKX)Z>K?R0V>=))
*K?M<;BFBJG>S);KLGB@Q<;KDG>)
.BGFFB@)1FGVG>;))
*QG;C;JG>)LGJ>=@GV>))
.B;=B?R*QKYB@)3;K?\BG=>))
%?LBM;G?BFBJG>S)LGKE]@>)>@)IKFKLG>=)I<@KEBFGHC>=))
.BC==>F)+B^M))
&KLGBFBJG>)>@)GIKJ>;G>)I<LGMKF>))
.;KX>)3KEG>??>))
*QG;C;JG>)DFK=@GHC>S);>MB?=@;CM@;GM>)>@)>=@Q<@GHC>))
.;>@B?):G>;;>))
*QG;C;JG>)IKPGFFBR[KMGKF>)>@)=@BIK@BFBJG>))
*KF>?L>;),FKG?))
W<?<@GHC>))
*QKD>@)1FGVG>;))
*K?M<;BFBJG>S);KLGB@Q<;KDG>)
*QKDC;FK@)&BFK?L))
&QCIK@BFBJG>))
*QK==K;L)-BIG?GHC>))
,?>=@Q<=GBFBJG>R;<K?GIK@GB?S)I<L>MG?>)LTC;J>?M>))
*QK@>FKG?):G>;;>))
:<LGK@;G>))
*Q>VKFG>;):QGFGDD>))
*K;LGBFBJG>))
*FK;G=)1FGVG>;))
:<LGK@;G>))
*BMQK@):G>;;>))
:<LGK@;G>))
*BFG?)*X;GFF>))
%DGL<IGBFBJG>S)<MB?BIG>)L>)FK)=K?@<)>@)D;<V>?@GB?))
*BFBIE>F)4K;M))
!;BFBJG>))
*B;LG>;)Z>K?R3;K?\BG=))
:?>CIBFBJG>S)KLLGM@BFBJG>))
*B@@G?)$G?M>?@))
:?>CIBFBJG>S)KLLGM@BFBJG>))
*B@@B?)3;K?\BG=))
,?K@BIG>))
-T,IK@B)(QG>;;X))
:=XMQGK@;G>)LTKLCF@>=S)KLLGM@BFBJG>))
-KFF>)'@<DQK?>))
->;IK@BRV<?<;<BFBJG>))
BERNARD
(CC BY-NC-ND 2.0)

->FKQKX>)3;K?\BG=))
*K;LGBFBJG>))
->?G=):QGFGDD>))
1DQ@KFIBFBJG>))
->=MB@>=)ZKMHC>=))
:QK;IKMBFBJG>))
->VBCK==BCP)4B_JK?))
,?K@BIG>)>@)MX@BFBJG>)DK@QBFBJGHC>=))
-G)3GFFGDB)'XFVG>))
*K;LGBFBJG>))
-G=K?@)3;K?\BG=))
1@BR;QG?BRFK;X?JBFBJG>))
-BC>`):QGFGDD>))
&KLGBFBJG>)>@)GIKJ>;G>)I<LGMKF>))
-CE>;?K;L)WGF))
WX?<MBFBJG>RBE=@<@;GHC>S)JX?<MBFBJG>)I<LGMKF>))
-CM>;[)*Q;G=@GK?))
*QG;C;JG>)LGJ>=@GV>))
-CIB?@>@)*QK;F>=))
a<IK@BFBJG>S)@;K?=[C=GB?))
-CIB;@G>;)Z<;BI>))
WK=@;B>?@<;BFBJG>S)Q<DK@BFBJG>S)KLLGM@BFBJG>))
-C;G>C)#=KE>FF>))
4<L>MG?>)G?@>;?>S)J<;GK@;G>)>@)EGBFBJG>)LC))
%L>;X)*QK;F>=))
W<?<@GHC>)>@)L>)FK);>D;BLCM@GB?S)JX?<MBFBJG>)I<LGMKF>))
"<J;G>;)4K;G>R'XFVG>))
*K?M<;BFBJG>S);KLGB@Q<;KDG>))
">X;>@):QGFGDD>))
*QG;C;JG>)B;@QBD<LGHC>)>@)@;KCIK@BFBJGHC>))
"GMBFG?B)4K;M))
:<LGK@;G>))
"GJQBJQB==GK?)"B;E>;@))
">C;BFBJG>))
"G?>@)ZKMHC>=))
4<L>MG?>)G?@>;?>))
"G?>@)Z>K?))
*QG;C;JG>)@QB;KMGHC>)>@)MK;LGBVK=MCFKG;>))
1EKLGK)Z>K?R3;K?\BG=))
*QG;C;JG>)@QB;KMGHC>)>@)MK;LGBVK=MCFKG;>))
1VGY>)4GMQ>F))
:QX=GBFBJG>))
:>;;G?)WGFF>=))
">C;BMQG;C;JG>))
:>X;KIB?L)-BIG?GHC>))
4KFKLG>)G?[>M@G>C=>=S)IKFKLG>=)@;BDGMKF>=))
:QGFGD)(QG>;;X))
*K?M<;BFBJG>S);KLGB@Q<;KDG>))
:GMB@)'@<DQK?>))
:K;K=G@BFBJG>)>@)IXMBFBJG>))
:GJ?K@)Z>K?R*Q;G=@GK?))
1@BR;QG?BRFK;X?JBFBJG>))
:B?M>@)WGFF>=))
*QG;C;JG>)J<?<;KF>))
:B?MQB?)(QG>;;X))
WK=@;B>?@<;BFBJG>S)Q<DK@BFBJG>S)KLLGM@BFBJG>))
:CJ>K@)4GMQ>F))
%?LBM;G?BFBJG>S)LGKE]@>)>@)IKFKLG>=)I<@KEBFGHC>=)
&KCL;K?@)-K?G>F))
WX?<MBFBJG>RBE=@<@;GHC>S)JX?<MBFBJG>)I<LGMKF>))
&KV>;B@)W<;KFL))
%?LBM;G?BFBJG>S)LGKE]@>)>@)IKFKLG>=)I<@KEBFGHC>=)))
&>V>F)-GLG>;))
&KLGBFBJG>)>@)GIKJ>;G>)I<LGMKF>))
&GMQK;L)Z>K?R*Q;G=@BDQ>))
&<K?GIK@GB?S)I<L>MG?>)LTC;J>?M>))
&GVBG;>)4GMQ>F))
*K?M<;BFBJG>S));KLGB@Q<;KDG>))
&BL>)WGFF>=))
4<L>MG?>)DQX=GHC>)>@)L>);<KLKD@K@GB?))
&B==>@@G)0V>=))
:QX=GBFBJG>))
&BC==B?)&BE>;@R4K;M))
.GBMQGIG>)>@)EGBFBJG>)IBF<MCFKG;>))
&BCVG];>)1FGVG>;))
&KLGBFBJG>)>@)GIKJ>;G>)I<LGMKF>))
&BX):K=MKF))
.GB=@K@G=@GHC>=S)G?[B;IK@GHC>)I<LGMKF>)>@))
BERNARD
(CC BY-NC-ND 2.0)

&CLGJBY)&>?<R*QK;F>=))
WX?<MBFBJG>RBE=@<@;GHC>S)JX?<MBFBJG>)I<LGMKF>))
&C[[GB?),FKG?))
!;BFBJG>))
&XVFG?):QGFGDD>))
">C;BFBJG>))
'KBCL)4BQKI>L))
:=XMQGK@;G>)LTKLCF@>=))
'MQK>[[>;)+KC;>?@))
.GBFBJG>)M>FFCFKG;>))
'MQ>GE>;)*Q;G=@GK?))
.GBDQX=GHC>)>@)I<L>MG?>)?CMF<KG;>))
'MQB@@R:>@Q>FKY),??>R4K;G>))
%DGL<IGBFBJG>S)<MB?BIG>)L>)FK)=K?@<)>@)D;<V>?@GB?))
'MBKY>M)Z>K?R0V>=))
,?K@BIG>)>@)MX@BFBJG>)DK@QBFBJGHC>=))
'BCHC>@)Z>K?R*Q;G=@BDQ>))
WK=@;B>?@<;BFBJG>S)Q<DK@BFBJG>S)KLLGM@BFBJG>))
(>;;K)Z>K?R+BCG=))
:=XMQGK@;G>)LTKLCF@>=S)KLLGM@BFBJG>))
(QGVBF>@R.>_CG)3;K?\BG=>))
,?K@BIG>)>@)MX@BFBJG>)DK@QBFBJGHC>=))
(GFG`>@>)*K;BFG?>))
:QX=GBFBJG>))
(BC;KG?>)Z>K?R+BCG=))
"<DQ;BFBJG>))
(;CX)%;GM))
1@BR;QG?BRFK;X?JBFBJG>))
(C;_IK?)3;K?MG=))
&KLGBFBJG>)>@)GIKJ>;G>)I<LGMKF>))
$KFF<>).>;?K;L))
,?K@BIG>))
$K?L>?>=MQ)3;K?\BG=))
.KM@<;GBFBJG>RVG;BFBJG>S)QXJG]?>)QB=DG@KFG];>))
$K?Q>I=):QGFGDD>))
%DGL<IGBFBJG>S)<MB?BIG>)L>)FK)=K?@<)>@)D;<V>?@GB?))
$C`C=GM)'K?L;K))
">C;BFBJG>))
bK@@>F)%;GM)a<IK@BFBJG>))
@;K?=[C=GB?))
cBCFGI)3KEG>?))
WK=@;B>?@<;BFBJG>S)Q<DK@BFBJG>S)KLLGM@BFBJG>))
)
%
J-8<,..,3-%4,.%()*+,-.*/0.%Q%F04,O*),%I0)0-2&,%
+>@;GFFGK;@)+KC;>?@))
4B;>KC),FKG?))
J-8<,..,3-.%2..8O*0.%4,%F04,O*),%I0)0-2&,%
3FB;G)4K;G>))
c>;EGE)0V>=))
J-8<,..,3-.%0?0-*/,.%
.<;K;L)Z<;dI>))
*QG;C;JG>)G?[K?@GF>))
.BCFK?J>;):G>;;>))
.KM@<;GBFBJG>RVG;BFBJG>S)QXJG]?>)QB=DG@KFG];>))
.BYGB),?L;<))
*K;LGBFBJG>))
*QKXVGKFF>)Z>K?R,FKG?))
WK=@;B>?@<;BFBJG>S)Q<DK@BFBJG>S)KLLGM@BFBJG>))
-KFGJK?L)+GFGK?>))
4<L>MG?>)F<JKF>)>@)L;BG@)L>)FK)=K?@<))
-;BY)Z>K?R:G>;;>))
*K?M<;BFBJG>S);KLGB@Q<;KDG>))
3FB;>@)-K?G>F))
:<LGK@;G>))
WQK;GE)*FKCL>))
:QX=GBFBJG>))
#@@G)&BFK?L))
.GBDQX=GHC>)>@)I<L>MG?>)?CMF<KG;>))
BERNARD
(CC BY-NC-ND 2.0)
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
1
/
63
100%