Alcools. - martinphysique

CTM4 Alcanes &
Alcools.
1èreS

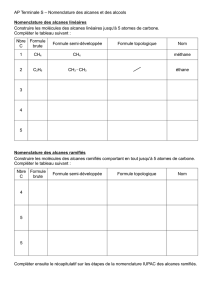
I. Nomenclature.
1.Alcanes.
Les alcanes sont constitués d’atomes de carbone et
d’hydrogène associés par des liaisons simples.
1èreS

2.Alcools.
Les alcools sont des molécules présentant un
groupe d’atomes hydroxyde –OH, porté par
un atome de carbone qui n ’est lié qu’à des
atomes de carbone ou d’hydrogène par des
liaisons simples.
1èreS

1èreS
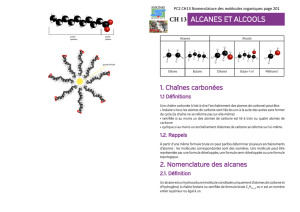
3. Les types de chaînes carbonées.
Si l’un des atomes de carbone est lié à au moins trois autres
atomes de carbone, la chaîne est dite ramifiée.
Si la chaîne se referme sur elle-même, la chaîne est dite
cyclique.
Sinon, la chaîne est dite linéaire.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
1
/
13
100%