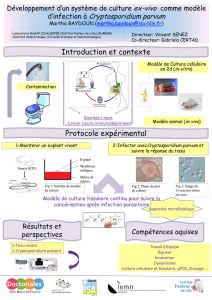
CRYPTOSPORIDIES

© 2012 Biomnis – PRÉCIS DE BIOPATHOLOGIE ANALYSES MÉDICALES SPÉCIALISÉES 1/3
CRYPTOSPORIDIES
Cryptosporidium est un protozoaire cosmopolite du
groupe des Coccidies, dont le cycle parasitaire peut se
produire chez un grand nombre d’espèces animales
(mammifères, reptiles, oiseaux et poissons). Il est
responsable de la cryptosporidiose, protozoose
intestinale connue de longue date en médecine
vétérinaire, mais qui n’a été identifiée chez l’homme
qu’en 1976. La principale espèce pathogène chez
l’homme est C. parvum. Initialement décrite comme la
cause de brefs épisodes diarrhéiques, principalement
chez l’enfant, elle est surtout connue depuis
l’émergence du sida provoquant, chez les malades
immunodéprimés, de graves syndromes diarrhéiques
cholériformes.
Synonymes : espèces responsables de la plupart des
cas de cryptosporidiose chez l’homme : Cryptosporidium
parvum, C. hominis, C. meleagridis, C. felis et C. canis.
La contamination de l’homme s’effectue par contact
avec des animaux ou individus infectés ou par ingestion
des oocystes du protozoaire en consommant de l’eau
ou des aliments souillés par les fécès d’un hôte infesté.
Une transmission nosocomiale a également été
évoquée. Le cycle du parasite se déroule dans les
entérocytes de l’hôte et dure en moyenne 3 jours. Les
différents stades parasitaires s’y succèdent, la phase
sexuée donnant naissance à de nouveaux oocystes
sporulés et résistants, éliminés dans les selles.
La prévalence de la cryptosporidiose est d’environ 2 %
dans les pays industrialisés et 6 % dans les pays en voie
de développement. Elle est surtout importante chez les
patients immunodéprimés, en particulier les sujets
infectés par le virus de l’immunodéficience humaine
(VIH) chez qui elle a atteint 14 à 24 %, en l’absence de
traitement anti-rétroviral.
Chez le sujet immunocompétent, la maladie touche
essentiellement les enfants de moins de 4 ans
(épidémies de crèche), les éleveurs, vétérinaires ou
personnels hospitaliers, ainsi que les voyageurs de
retour d’un pays à bas niveau d’hygiène. Elle est
asymptomatique ou se manifeste, après une incubation
de 5 à 21 jours, par une gastro-entérite avec diarrhée
aqueuse (3 à 6 selles, parfois plus/jour ; sang et
leucocytes rares) spontanément résolutive en 1 à 2
semaines.
Chez l’immunodéprimé, la cryptosporidiose entraîne
une diarrhée aqueuse, cholériforme, faite de 10 à 20
selles par jour, mais pouvant alterner avec des périodes
de transit normal, voire de constipation. Le volume
quotidien des selles est généralement très important,
pouvant atteindre 10 litres/jour, voire plus. La diarrhée
peut durer quelques semaines, mais persiste
généralement plusieurs mois, conduisant au décès du
patient dans un tableau de désordre
hydroélectrolytique et de cachexie majeurs. Des
atteintes biliaires et respiratoires ont aussi été décrites.
– Diarrhée aiguë ou chronique
* chez les sujets immunodéprimés : les patients infectés
par le VIH ayant moins de 200 lymphocytes CD4/mm
3
,
les patients d’oncologie et d’hématologie.
* chez les sujets immunocompétents : les enfants en
collectivité, les sujets en contact avec des animaux, le
personnel hospitalier, les voyageurs, ou en cas
d’épidémie de diarrhée, notamment hospitalière
(infection nosocomiale). Cette recherche doit toujours
être précédée de 3 examens parasitologiques des selles
(EPS) à 2-3 jours d’intervalle. Si les 3 EPS sont négatifs et
si les symptômes persistent, il convient de rechercher,
entre autres, les cryptosporidies.
– Atteinte pulmonaire ou hépatobiliaire chez un sujet
immunodéprimé (surtout patient VIH + ayant moins de
50 CD4/mm
3
) ou recherche d’un portage
asymptomatique dans l’entourage d’un sujet atteint.
PRELEVEMENT
- Selles fraîchement émises ; l’élimination des oocystes
étant intermittente, il est recommandé d’effectuer la
recherche sur au moins 3 échantillons à 2-3 jours
d’intervalle.
- Biopsies duodénales ou intestinales.
- Autres : liquides de lavage broncho-alvéolaires,
prélèvements biliaires…
QUESTIONS A POSER AU PATIENT
Notion d’immunodépression (infection par le VIH,
traitement en cours par un immunosuppresseur ou un
anticancéreux) ?
Antécédents d’EPS standard ?
CONSERVATION ET TRANSPORT
Conservation et transport des selles à + 4 °C jusqu’à
l’analyse. En raison du risque non négligeable de
contamination, il convient de prendre certaines
précautions : mélanger l’échantillon avec du formol à
10 %, porter des gants, un masque et des lunettes pour
la manipulation.
CRYPTOSPORIDIES
INDICATIONS DE LA RECHERCHE
DEFINITION
BIOPATHOLOGIE
RECOMMANDATIONS PREANALYTI
Q
UES

© 2012 Biomnis – PRÉCIS DE BIOPATHOLOGIE ANALYSES MÉDICALES SPÉCIALISÉES 2/3
CRYPTOSPORIDIES
- Examen parasitologique direct d’un frottis de selles,
permettant la mise en évidence des oocystes du
parasite. Une concentration des selles (technique de
Ritchie) est recommandée, en particulier lorsqu’il s’agit
d’une recherche de portage sain, chez un sujet en
contact avec un patient atteint.
NB : les cryptosporidies ne sont pas mises en évidence
par les techniques classiques de parasitologie des
selles : la recherche spécifique doit donc être précisée
par le médecin prescripteur afin de mettre en œuvre les
techniques appropriées. L’initiative de cette recherche
peut également être prise par le biologiste en fonction
des informations cliniques ou épidémiologiques
recueillies.
La méthode de coloration donnant les meilleurs
résultats pour la recherche spécifique de
cryptosporidies est la méthode de Ziehl-Nielsen
modifiée après concentration au formol-éther
(coloration à la fuchsine phéniquée ; contre coloration
au vert malachite). Elle est facile et assez rapide à
réaliser (90 min), peu coûteuse et permet également le
diagnostic de Isospora belli et Cyclospora.
D’autres colorations peuvent être utilisées, notamment
la coloration par l’auramine, facile et rapide, mais elle
nécessite un microscope à fluorescence et ne permet
pas le diagnostic de Isospora belli et Cyclospora.
L’utilisation de réactifs contenant un anticorps
monoclonal fluorescent dirigé contre la paroi de
l’oocyste, avec lecture au microscope à fluorescence, est
également possible et permet aussi le diagnostic de
Giardia. Toutefois, elle nécessite un microscope à
fluorescence et ne permet pas le diagnostic de Isospora
belli et Cyclospora.
- Détection d’antigènes de Cryptosporidium : des tests
immunochromatographiques sont disponibles et
simples d’utilisation ; la recherche est plus coûteuse,
mais peut être effectuée par du personnel non entraîné
au diagnostic parasitologique microscopique. La
spécificité de ces tests est excellente, mais leur
sensibilité est comprise entre 70 et 90 % pour les
espèces C. parvum et C. hominis (< 30 % pour les autres
espèces). Des tests Elisa ont également été développés ;
ils ont de bonnes performances (sensibilité : 91-93 % ;
spécificité : 96,5 – 100 %), mais sont surtout utilisés pour
des enquêtes de masse et très peu en LBM.
- Biologie moléculaire : mise en évidence de l’ADN de
Cryptosporidium par PCR. Cette technique est très
sensible et permet un diagnostic d’espèce et de sous-
espèce. Elle reste toutefois réservée à des laboratoires
spécialisés ou de référence.
Le diagnostic repose principalement sur la mise en
évidence du parasite à l’examen direct d’un frottis de
selles (après concentration ou non). Compte tenu de
l’élimination discontinue des oocystes, un résultat ne
pourra être rendu négatif qu’après examen de trois
échantillons. NB : C. parvum peut être retrouvé dans des
selles diarrhéiques ou des selles moulées. A l’examen
direct, les oocystes apparaissent de forme arrondie,
réfringents, sans élément caractéristique permettant le
diagnostic spécifique de C. parvum.
Après coloration par la technique de Ziehl-Nielsen
modifiée : les oocystes de cryptosporidies apparaissent
colorés en rouge sur fond bleu-vert. Ils sont détectables
dès l’objectif x 20 (5-8 μm). Au fort grossissement (à
l’immersion), il est possible de distinguer le corps
résiduel (noir), les noyaux des sporozoïtes (noirs) et une
vacuole au sein d’un cytoplasme granuleux. Le
diagnostic précis d’espèce pourra être porté par les
techniques d’amplification génique.
Diagnostic morphologique différentiel avec d’autres
entéropathogènes décrits dans un contexte clinique
similaire (coloration de Ziehl-Nielsen modifiée, examen à
l’immersion)
Taille
(en microns)
Caractéristiques au
Ziehl-Nielsen
Oocystes de
Cryptosporidium parvum
5 à 7 Colorés en rouge ;
Corps résiduel et
noyaux des
sporozoïtes (noirs),
vacuole, cytoplasme
granuleux
Oocystes de Cyclospora
cayetanensis
8 à 10 Colorés en rouge,
mais de manière
hétérogène au sein
d’un même frottis
Oocystes d’Isospora Belli 20 à 33 x 10 à 19 Colorés en rouge ;
forme ovalaire, en
obus, grande taille
Levures 2 à 10 Colorées en vert
Globules lipidiques Très variable Colorés en rose,
dépourvus
d’organisation
interne
Chez les patients ayant une symptomatologie digestive
(gastro-entérite, diarrhée), l’isolement de C. parvum
permet de conclure à une cryptosporidiose. Chez
l’immunodéprimé, l’atteinte digestive est parfois
associée à une atteinte pulmonaire ou biliaire (C.
parvum peut alors être isolé dans la bile).
Après guérison ou en cas d’infections récidivantes, un
portage asymptomatique peut perdurer plusieurs
semaines.
METHODES DIAGNOSTIQUES INTERPRETATION DES RESULTATS

© 2012 Biomnis – PRÉCIS DE BIOPATHOLOGIE ANALYSES MÉDICALES SPÉCIALISÉES 3/3
CRYPTOSPORIDIES
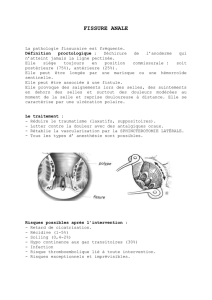
Traitement – Prévention des infections
Le traitement est avant tout symptomatique, avec
réhydratation dans les cas graves. Chez le patient VIH+,
le traitement anti-rétroviral, en restaurant l’immunité,
favorise la prévention et le contrôle de la
cryptosporidiose. Un traitement par macrolide
(azithromycine, clarithromycine, spiramycine) peut être
utilisé.
La prévention de la cryptosporidiose humaine repose,
en milieu hospitalier, sur la mise en œuvre de mesures
spécifiques (lavage soigneux des mains, port de gants,
traitement des effluents…). Chez les patients
immunodéprimés et les voyageurs en zones à bas
niveaux d’hygiène, les principales recommandations
sont de boire de l’eau minérale en bouteille ou de l’eau
bouillie ou filtrée (0,2 microns), de renforcer l’hygiène
des mains, d’éviter les bains en eaux non contrôlées
(lacs, rivières, bases de loisirs) et les contacts avec des
animaux susceptibles d’être contaminés (jeunes veaux).
.
POUR EN SAVOIR PLUS
Bonnin A., Dalle F., Dautin G., Cryptosporidium, agent
pathogène des cryptosporidioses, Encycl Med Biol, Elsevier,
Paris, 2003.
Deluol A.M. Coccidioses intestinales, Feuillets de Biologie
1997; XXXVIII (214): 47-51.
Paugam A., Tourte-Schaefer C., Commentaire sur les frottis
de selles contenant Cryptosporidium sp. In: Annales du
contrôle national de qualité n°1. Agence du médicament,
Saint-Denis, 1995: 48-50.
Guyot K., Sarfati C., Derouin F., Actualités sur
l’épidémiologie et le diagnostic de la cryptosporidiose,
Feuillets de Biologie 2012 (janv) ;304 :21-29.
1
/
3
100%