424 CHIMIE ORGANIQUE

424 CHIMIE ORGANIQUE SYNTHESE DE LA BUTAN-2-ONE
Conception : Collège de Staël Adaptation: M.Casanova & H. Jenny Collège de Candolle 2009
BUT Préparation de la butan-2-one par oxydation du butan-2-ol avec de l'eau de Javel
METHODE Deux étapes :
A. Synthèse de la butan-2-one : Oxydation d’un alcool secondaire →cétone
B. Analyse du produit obtenu :
✔Test au DNPH : mise en évidence de la fonction carbonyle
Il identifie les aldéhydes et les cétones
✔Mesure de l'indice de réfraction n D
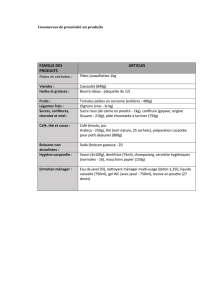
PRODUITS •Acide éthanoïque (acétique) 25%
•Butan-2-ol
•DNPH (2,4 dinitrophénylhydrazine)
•Hypochlorite de sodium 12-14% (eau de Javel)
•solution aqueuse d'acétate de sodium (36,5 g./ 30 ml)
•solution aqueuse d'hydrogénosulfite de sodium 37% (bisulfite de sodium)
RECOMMANDATIONS Rappel: LUNETTES, BLOUSES ET GANTS OBLIGATOIRES!
Ne pas mélanger les produits; refermer immédiatement les flacons.
Travailler sous chapelle;dès que possible abaisser la vitre.
APPAREILLAGE Placer la légende:
1. acide éthanoïque
2. butan-2-ol
3. butan-2-one
4. eau de Javel
5. solution d'acétate de sodium
6. solution d'hydrogénosulfite de sodium
I. agitateur/chauffage
II. ampoule d'introduction
III. bain glacé
IV. ballon de réaction
V. barreau magnétique, pierre à ébullition
VI. colonne de distillation Vigreux
VII. récipient de récupération
VIII. réfrigérant
IX. thermomètre
424 synthese de la butan_2_one.odt 1 / 3 Mise à jour 08/01/09
1
R
R2
C O
0
10

MANIPULATIONS A) SYNTHESE
1. Plonger le ballon de 2 cols dans le cristallisoir rempli d'eau et de glace
2. Introduire dans le ballon:- 25 ml d'acide éthanoïque (acétique) 25% aq.
- 10 ml de butan-2-ol
- 1 barreau magnétique
- 2 pierres à ébullition
3. Agiter et laisser refroidir ~ 5 min. jusqu'à ~ 10 o C
4. A l'aide d'un cylindre gradué de 100 ml, prélever 70 ml d'eau de Javel (13-15%).
Transférer ~50 ml d'eau de Javel dans l'ampoule d'introduction.
5. En maintenant l'agitation, faire couler goutte à goutte de l'eau de Javel à un rythme
soutenu (dès le début de l'opération la solution se trouble et un léger grondement se
fait entendre).
6. Après avoir introduit le reste de l'eau de Javel (~20 ml préparé au point 4), enlever le
bain de glace et agiter à température ambiante pendant 10 minutes.
7. Ajouter dans le ballon: - 5 gouttes d'hydrogénosulfite de sodium 37%aq.
- 30 ml d'acétate de sodium
8. Brancher le chauffage (calotte ou plaque chauffante) sur la position indiquée sur
l'appareil. Observer les vapeurs. Début de la distillation 79 o C→ 85 o C
Fin de la distillation lors de la cessation des vapeurs.
Noter dans le tableau ci-dessous le point d'ébullition pratique.
B) ANALYSE
✔Test au DNPH: Mise en évidence de la fonction carbonyle
(2,4-dinitrophénylhydrazine)
Il réagit avec une aldéhyde ou une cétone selon la réaction:
(précipité jaune)
DNPH
+
H
2O
H
+
NNH
NO2
2
NO
C
NO2
2
NO
CO+H2N NH
1
R
R2
1
R
R2
Introduire dans 3 éprouvettes éprouvette 1 éprouvette 2 éprouvette 3
réactif: DNPH 1 ml 1 ml 1 ml
2-3 gouttes du produit à tester cétone
à disposition
butan-2-ol butan-2-one
synthétisé
Notez vos observations
✔Mesure de l'indice de réfraction n D
L'indice de réfraction est une mesure d'angle qu'on observe quand un rayon lumineux
passe d'un milieu à l'autre. Il permet d'identifier et de vérifier la pureté d'un produit.
Appareillage: le réfractomètre de Abbe.
Tableau à compléter butan-2-ol butan-2-one
Indice de réfraction pratique
(réfractomètre)
n Dthéorique
(Handbook)
Point d'ébullition pratique
(thermomètre)
b.p [ o C] théorique
(Handbook)
424 synthese de la butan_2_one.odt 2 / 3 Mise à jour 08/01/09
1
R
R2
C O

QUESTIONNAIRE
1. Compléter et équilibrer la réaction de la synthèse de la butan-2-one
............................... + NaClO → ............................... + NaCl + H2O
butan-2-ol butan-2-one
OXYDATION :
REDUCTION:
BILAN :
2. Outre l'eau de Javel, il existe plusieurs agents oxydants efficaces tels que le trioxyde de chrome ( CrO3 ) en milieu
acide sulfurique ou le dichromate de disodium (Na2Cr2O7) en milieu acide sulfurique.
a) Équilibrer l'équation et mettre en évidence l'oxydant, le réducteur, l'oxydé, le réduit:
........................... + Na2Cr2O7 + H2SO4 → ............................... + Cr2 (SO4)3 + Na2SO4 + H2O
éthanol éthanal
OXYDATION :
REDUCTION :
BILAN :
b) Sachant que la couleur d'une solution contenant du chrome est orange si il y a du chrome (+6) et verte si il y a
du chrome (+3); comment pourriez-vous affirmer que la réaction d'oxydation a bien eu lieu?
c) Qu'arriverait-il si il y avait un excès d'oxydant lors d'une oxydation:
d'un alcool primaire qui donne une aldéhyde?
d'un alcool secondaire qui donne une cétone?
d) Qu'obtenez-vous par oxydation du 2-méthylpropan-2-ol? Justifiez votre réponse
RECUPERATION Vider les résidus dans le bidon de récupération « ORGANIQUE ».
Rincer la verrerie utilisée à l'eau du robinet.
424 synthese de la butan_2_one.odt 3 / 3 Mise à jour 08/01/09
1
/
3
100%