Pseudomalabsorption de L-thyroxine : une forme de pathomimie

Pseudomalabsorption de L-thyroxine :
une forme de pathomimie
Laurent Molines, Isabelle Fromont, Nathalie Morlet-Barla, Juan-Patricio Nogueira,
René Valéro, Bernard Vialettes
Reçu le 17 juillet 2006
Accepté le 28 septembre 2006
Disponible sur internet :
le 18 avril 2007
Service de nutrition, maladies métaboliques et endocrinologie,
Hôpital La Timone, Marseille (13)
Correspondance :
Laurent Molines, Service de nutrition, maladies métaboliques et endocrinologie,
Hôpital La Timone, 264 rue Saint-Pierre, 13385 Marseille Cedex 05.
■Summary
L-thyroxine pseudomalabsorption: a factitious disease
Introduction > Thyroxine supplementation of patients with hypothy-
roidism is usually simple. A few patients, however, continue to pre-
sent elevated TSH levels despite large doses of L-thyroxine.
Case > We report the case of a 71-year-old women who had had a
thyroidectomy 10 years earlier and had since been hospitalized
repeatedly for profound hypothyroidism. Despite her consistent
claims of good adherence to her treatment regimen, we considered
the diagnosis of L-thyroxine pseudomalabsorption and confirmed it
by thyroid hormone absorption tests.
Discussion > L-thyroxine pseudomalabsorption due to concealed poor
treatment adherence should be considered after ruling out drug or
dietary interference and true organic malabsorption. Diagnosis of this
factitious disease can be confirmed by L-thyroxine absorption tests.
■Résumé
Introduction > La substitution hormonale de l’hypothyroïdie est
habituellement simple. Cependant, certains patients ont des TSH
élevées malgré de fortes doses de L-thyroxine.
Observation > Nous rapportons l’observation d’une patiente de
71 ans, thyroïdectomisée depuis 10 ans, hospitalisée à plusieurs
reprises pour des épisodes d’hypothyroïdie profonde. Elle nous assu-
rait d’une bonne adhésion à l’opothérapie substitutive. Le diagnostic
de pseudomalabsorption de la L-thyroxine a été envisagé, puis
confirmé par des tests d’absorption des hormones thyroïdiennes.
Discussion > Une pseudomalabsorption de la L-thyroxine par mau-
vaise compliance thérapeutique dissimulée ne peut être évoquée
qu’après avoir éliminé une interférence médicamenteuse et/ou
nutritionnelle et une malabsorption organique vraie. Il s’agit d’une
maladie factice dont le diagnostic peut être affirmé par des tests
d’absorption de la L-thyroxine.
en ligne sur / on line on
www.masson.fr/revues/pm
Presse Med. 2007; 36: 1390–4
© 2007 Elsevier Masson SAS
Tous droits réservés.
tome 36 > n° 10 > octobre 2007 > cahier 1
doi: 10.1016/j.lpm.2006.09.024
1390 Cas clinique

L’hypothyroïdie est une maladie fréquente, non seule-
ment en endocrinologie mais aussi en médecine générale. Le
traitement, simple et peu coûteux, en est bien codifié. Il
repose sur la supplémentation hormonale par la L-thyroxine,
en une prise quotidienne le matin à jeun, basée sur un objectif
de normalisation de la Thyroid Stimulating Hormone (TSH),
voire un freinage de la TSH après chirurgie thyroïdienne onco-
logique. Les besoins hormonaux moyens en L-thyroxine sont
évalués à 1,7 ± 0,4 mg/kg/j en une prise quotidienne à jeun
pour une meilleure absorption. De 70 à 100 % de la dose
administrée est normalement absorbée au niveau du jéjunum,
avec un pic sérique à la deuxième heure. Ainsi, 90 % des
patients substitués voient leur TSH normalisée sous 100 à
200 mg/j [1, 2].
Il existe pourtant quelques patients chez lesquels la TSH
demeure élevée, en dépit de l’augmentation parfois considé-
rable des doses de L-thyroxine. Si la mauvaise observance
banale en est la première cause, cette situation s’observe
généralement en cas d’interférence médicamenteuse ou nutri-
tionnelle, ou de malabsorption de l’opothérapie substitutive.
Cependant, dans de rares occasions, les explorations prati-
quées devant cette résistance apparente au traitement
demeurent négatives. Il faut alors envisager la possibilité
d’un diagnostic d’exclusion, la “pseudomalabsorption”liée à
une mauvaise compliance au traitement, malgré les dénéga-
tions énergiques du patient. Cet état pathologique, subreptice-
ment créé par le patient lui-même, entre dans le cadre des
pathomimies.
Nous rapportons une observation de pseudomalabsorption de
la L-thyroxine dont les conséquences auraient pu être graves,
en détaillant le bilan étiologique et les tests utiles à réaliser
dans cette situation.
Observation
Une femme âgée de 71 ans était traitée par L-thyroxine pour une
hypothyroïdie secondaire à une thyroïdectomie totale pour goitre
multinodulaire plongeant en 1995. Au décours de la chirurgie,
une substitution hormonale était débutée (L-thyroxine 100 mg/j
en comprimés). Il existait dès lors des difficultés d’équilibration
permanentes, avec un nomadisme médical important.
En mars 2005, la patiente était hospitalisée en neurologie pour
des troubles du comportement alors attribués à une “psychose
myxœdémateuse”devant l’existence d’une hypothyroïdie pro-
fonde (TSH = 210 mUI/L, LT3 et LT4 indosables). L’évolution
était rapidement favorable avec régression des troubles neuro-
logiques et normalisation de la TSH, 15 j après reprise de
l’opothérapie substitutive (L-thyroxine 100 mg/j en gouttes).
Deux mois plus tard, la patiente était adressée en service
d’endocrinologie par son médecin traitant qui ne parvenait pas
àl’équilibrer sur le plan thyroïdien, et ce malgré le traitement
substitutif inchangé (TSH = 143 mUI/L). Un problème de malab-
sorption ou d’une mauvaise compliance thérapeutique étaient
alors évoqués, sans qu’aucun élément clinique ou paraclinique
ne permette de trancher définitivement. Le test d’absorption
des hormones thyroïdiennes était alors réalisé en milieu hospi-
talier (dose de charge de 400 mg de L-thyroxine per os,encom-
primés), il n’était pas en faveur d’une malabsorption organique
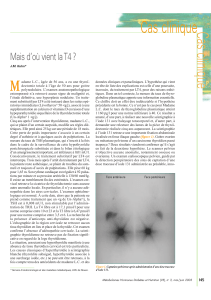
(figure 1A),etl’hospitalisation se conclut finalement par une
Figure 1
Évolution de la LT4 et de la LT3 en fonction du temps après une dose de charge de 400 mmg de L-thyroxine administrée sous forme
de comprimés (A) ou de gouttes (B)
Les différences de niveau de base de LT4 s’expliquent par le fait que ces 2 tests n’ont pas été réalisés au même moment de la reprise progressive de la supplémentation
hormonale.
Pseudomalabsorption de L-thyroxine : une forme de pathomimie
tome 36 > n° 10 > octobre 2007 > cahier 1
1391 Cas clinique

substitution par voie intra-musculaire (IM) avec une infirmière à
domicile : L-thyroxine 400 mg 2 fois par semaine. À 3 mois, le
bilan était corrigé, il existait même un léger surdosage, condui-
sant à réduire la posologie à 600 mg/semaine. Mais devant les
réticences de la patiente à poursuivre son traitement par voie
IM, une substitution par L-thyroxine per os était reprise à la
dose de 125 mg/j.
Quatre mois après, la patiente était de nouveau adressée en
milieu hospitalier pour hypothyroïdie profonde. À l’entrée, le
poids était de 41 kg (+ 3 kg en 6 mois), la taille de 1,45 m soit
un BMI à 19,5 kg/m
2
; la pression artérielle était à
110/70 mmHg, et la fréquence cardiaque à 58 Bpm. La
patiente se plaignait d’asthénie, d’une alternance diarrhée-
constipation ancienne, d’une sécheresse cutanéo-muqueuse
et de crampes des membres inférieurs. Elle niait tout défaut
d’observance du traitement substitutif. L’examen somatique
était sans particularités, en dehors d’une fragilité des phanè-
res. L’ECG trouvait une bradycardie sinusale à 50 Bpm. On
notait dans ses antécédents personnels une bronchopneumo-
pathie chronique obstructive post-tabagique (tabac 40
paquets/année actif), un syndrome dépressif avec notion de
troubles du comportement alimentaire de type anorexie-
boulimie survenus il y a plusieurs années, consécutifs au sui-
cide de son fils.
Le traitement comprenait L-thyroxine125 mg/j en comprimés,
zolpidem, alprazolam et hydroxyzine. Elle ne consommait ni
phytothérapie, ni aliments susceptibles d’interférer avec
l’opothérapie substitutive (soja, noix, prunes, etc.).
Il existait bien une hypothyroïdie biologique profonde,
TSH = 183 mUI/L (N = 0,27-4,20) LT3 = 1,79 pmol/L (N = 3,1-6,8)
et LT4 = 5,7 pmol/L (N = 13-23). Un bilan de malabsorption est
réalisé :
•bilan martial normal ;
•absence d’élément en faveur d’une maladie cœliaque (anti-
corps anti-transglutaminase négatifs, absence d’atrophie villo-
sitaire sur les biopsies duodénales) ;
•absence de carence en vitamine B12 ou folates ;
•gastrine et vitamines liposolubles normales ;
•fibroscopie œsogastroduodénale et coloscopie normales.
Évoquant un exceptionnel problème d’absorption de L-thyroxine
lié à la galénique, sous forme de comprimés, nous avons réalisé
un nouveau test d’absorption des hormones thyroïdiennes en
solution buvable : au décours d’une nuit de jeûne, dosage de
la LT4 horaire pendant 6 heures suivant l’administration per os
d’unedosedechargede400mg de L-thyroxine en gouttes,
après réalisation d’un électrocardiogramme et sous contrôle
médical strict (figure 1B). Au début du test, les valeurs biologi-
ques confirmaient le statut d’hypothyroïdie (LT4 = 9,7 pmol/L) ;
on observait, au décours de l’ingestion de L-thyroxine, une élé-
vation des taux de LT4 jusqu’à normalisation (pic à la 5
e
heure :
LT4 = 18,4 pmol/L, soit une élévation de 90 %). Ces résultats
corroboraient ceux du test précédent et infirmaient l’hypothèse
d’une malabsorption liée à la forme galénique, gouttes versus
comprimés. Compte tenu du refus de la patiente d’une reprise
des injections de L-thyroxine, l’option choisie a été de mettre en
place une surveillance quotidienne de la bonne prise du traite-
ment (L-thyroxine gouttes 100 mg/j) par une infirmière au
domicile. L’évolution hormonale est venue conforter le diagnos-
tic de pseudomalabsorption des hormones thyroïdiennes chez
cette patiente : un mois après la sortie, la TSH était un peu
basse (TSH = 0,09 mUI/l), incitant à baisser la posologie de
Encadré 1
Causes de résistance à l’opothérapie substitutive par L-thyroxine
Malabsorption organique
•Maladie cœliaque [12]
•Maladie de Biermer
•Intolérance au lactose
•Hépatopathie cholestatique
•Insuffisance pancréatique exocrine
•Chirurgie gastro-intestinale [13, 14]
Interférence médicamenteuse
•Colestyramine [15]
•Anti-acides (hydroxyde d’aluminium) [16]
•Cimétidine [17]
•Résines échangeuses d’ions
•Laxatifs [16]
•Charbon activé [18]
•Carbonate de calcium [19]
•Sels de fer [20]
•Propanolol [21]
•Lovastatine [22],Simvastatine[23]
•Amiodarone [24]
•Oestrogénothérapie [25]
•Raloxifène [26]
•Rifampicine [27]
•Phénobarbital [28]
•Phénytoïne [29]
•Carbamazépine [30]
•Imatinib [31]
•Sertraline [32]
Interférence nutritionnelle
•Soja [33]
•Prunes [34]
•Noix [34]
•Phytothérapie [35]
Autres
•Grossesse [36]
•Insuffisance cardiaque [37]
•Syndrome néphrotique [38]
•Gastrite à Helicobacter Pylori [39]
Molines L, Fromont I, Morlet-Barla N, Nogueira JP, Valéro R, Vialettes B
tome 36 > n° 10 > octobre 2007 > cahier 1
1392

L-thyroxine à 80 mg/j, et un mois plus tard le bilan thyroïdien
était normalisé (TSH = 0,38 mUI/L ; LT4 = 26,3 pmol/L ;
LT3 = 5,78 pmol/L).
Discussion
Nous rapportons ici un cas de pseudomalabsorption de L-
thyroxine, chez une malade thyroïdectomisée, secondairement
à une mauvaise adhérence thérapeutique catégoriquement
déniée par la malade. La mauvaise observance du traitement
substitutif représente une des plus fréquentes causes des dif-
ficultés d’équilibration du bilan thyroïdien chez une patiente
hypothyroïdienne. Chaque spécialiste confronté à une telle
situation ne doit pourtant pas oublier qu’il s’agit d’un diagnos-
tic d’élimination imposant d’exclure tous les autres facteurs
susceptibles d’interférer avec un bon équilibre hormonal. Une
fois cette étape franchie, le test d’absorption des hormones
thyroïdiennes, en milieu hospitalier, confirme le diagnostic et
permet de mettre en place un mode de traitement dont la
responsabilité est assurée par un tiers.
Le diagnostic doit rester un diagnostic d’élimination devant
faire écarter toute cause de résistance à l’opothérapie substi-
tutive (encadré 1). Il faut bien entendu éliminer une malab-
sorption organique vraie ; parallèlement, il est important de
rechercher une interférence médicamenteuse pouvant
conduire à une diminution de l’absorption des hormones thy-
roïdiennes (sels de fer, colestyramine, carbonate de calcium,
etc.), à une inhibition de la désiodation (propanolol, amioda-
rone, etc.), à une augmentation de la clairance (sertraline par
exemple) ou du catabolisme des hormones par induction
enzymatique des CYP1A2 et/ou CYP3A4 (lovastatine, simvas-
tatine, anti-comitiaux, imatinib, etc.), ce d’autant que certaines
de ces thérapeutiques ne sont pas systématiquement signa-
lées par les malades (fer, calcium, laxatifs, etc.).
Des différences en termes de pharmacocinétique entre les
diverses préparations de L-thyroxine per os ont été signalées
à certaines occasions dans la littérature, mais on considère
généralement que ces préparations sont identiques en termes
de biodisponibilité [3, 4]. Nous ne reviendrons pas sur les
préparations galéniques dont le contenu en LT4 n’est pas celui
annoncé [5, 6] ; une meilleure absorption des comprimés une
fois broyés [7] et une différence d’efficacité entre gouttes et
comprimés [8, 9] ont été décrites, suggérant que chez certains
patients, un mauvais délitement des comprimés peut participer
à une résistance apparente au traitement substitutif.
Certains éléments propres aux pathomimies peuvent venir
renforcer le diagnostic de pseudomalabsorption : terrain psy-
chologique fragile (ici les antécédents de troubles du compor-
tement alimentaire dans le contexte de perte d’un enfant)
mais sans maladie psychiatrique évidente, une complaisance
à tous les tests et solutions thérapeutiques proposés, un déni
formel de tout manque de compliance, un nomadisme médi-
cal, etc. Le test d’absorption des hormones thyroïdiennes après
une dose de charge de L-thyroxine par voie orale, réalisé dans
de bonnes conditions (patient à jeun, surveillance médicale de
la bonne prise du traitement, de l’absence de vomissements
et de l’absence d’effets indésirables), fera définitivement la
part entre malabsorption vraie et pseudomalabsorption :
l’élévation franche voire la normalisation de la LT4 éliminant
une malabsorption organique. Les doses habituellement pro-
posées se situent entre 1 000 et 2 000 mg de L-Thyroxine,
nous avons opté pour une dose plus faible justifiée par l’âge
de la patiente, sans pour autant perdre en information.
La prise en charge de ce type de patient, comme de toute
pathologie factice, est délicate. Toute confrontation brutale
médecin-patient est inutile voire délétère. Plusieurs solutions
sont envisageables pour équilibrer ce type de patient. L’utilisa-
tion de la voie parentérale, essentiellement intramusculaire
avec une infirmière au domicile, donne de bons résultats
[10]. Faire superviser la bonne prise du traitement par une
infirmière au domicile après avoir normalisé le bilan en milieu
hospitalier, et démontré par là même à la patiente que cela
était possible, peut constituer une alternative. Dans ce cas,
une administration hebdomadaire d’une dose de L-thyroxine
légèrement supérieure à 7 fois la posologie quotidienne peut
être intéressante [11].
Conflits d’intérêts : aucun
Références
1 Toft AD. Thyroxin therapy. N Engl J Med.
1994; 331: 174-80.
2 Lips DJ, Van Reisen MT, Voigt V, Venekamp W.
Diagnosis and treatment of levothyroxine
pseudomalabsorption. Neth J Med. 2004; 62:
114-8.
3 Stoffer SS, Szpunar WE. Potency of brand
name and generic levothyroxine. JAMA.
1980; 244: 1704-5.
4 Grussendorf M, Vaupel R, Wegscheider K.
Bioequivalence of L-thyroxine tablets and
a liquid L-thyroxine solution in the treatment
of hypothyroid patients. Med Klin. 2004; 99:
639-44.
5 Peran S, Garriga MJ, Morreale de Escobar G,
Asuncion M, Peran M. Increase in plasma
thyrotropin levels in hypothyroid patients
during treatment due to a defect in, com-
mercial preparation. J Clin Endocrinol Metab.
1997; 82: 3192-5.
6 Sawin CT, Surks MI, London M, Ranganathan C,
Larsen PR. Oral thyroxine: variation in biologic
action and tablet content. Ann Intern Med.
1984; 100: 641-5.
7 Yamamoto T. Tablet formulation of levothyro-
xine is absorbed less well than powdered
levothyroxin. Thyroid. 2003; 13: 1177-81.
8 Rossi D, Simonin G, Carayon P, Codaccioni JL.
Traitement substitutif de l’hypothyroïdie par
la Dl-thyroxine. Les comprimés ne valent pas
les gouttes. Presse Med. 1984; 13: 679-80.
9 Vaisman M, Spina LD, Eksterman LF,
dosSantosMJ,LimaJS,VolpatoNMet al.
Pseudomalabsorption de L-thyroxine : une forme de pathomimie
tome 36 > n° 10 > octobre 2007 > cahier 1
1393 Cas clinique

Comparative bioavailability of two oral L-
thyroxine formulations after multiple dose
administration in patients with hypothy-
roidism and its relation with therapeutic
endpoints and dissolution profiles. Arznei-
mittelforschung. 2001; 51: 246-52.
10 Jauk B, Mikosch P, Gallowitsch HJ, Kresnik E,
Molnar M, Gomez I et al. Unusual malabsorp-
tion of levothyroxine. Thyroid. 2000; 10:
93-5.
11 Grebe SK, Cooke RR, Ford HC, Fagerstrom JN,
Cordwell DP, Lever NA et al. Treatment of
hypothyroidism with once weekly thyroxine.
J Clin Endocrinol Metab. 1997; 82: 870-5.
12 McDermott JH, Coss A, Walsh CH. Celiac
disease presenting as resistant hypothyroi-
dism. Thyroid. 2005; 15: 386-8.
13 Bevan JS, Munro JF. Thyroxin malabsorption
following intestinal bypass surgery. Int J Obes.
1986; 10: 245-6.
14 Smyrniotis V, Vaos N, Arkadopoulos N,
Kopstopannagiotou G, Theodoraki K,
Lambrou A. Severe hypothyroidism in
patients dependent on prolonged thyro-
xine infusion through a jejunostomy. Clin
Nutr. 2000; 19: 65-7.
15 Rosenberg R. Malabsorption of thyroid hor-
mone with cholestyramine administration.
Conn Med. 1994; 58: 109.
16 Mersebach H, Rasmussen AK, Kirkegarrd L,
Feldt-Rasmussen U. Intestinal adsorption of
levothyroxine by antiacids and laxatives:
case stories and in vitro experiments. Phar-
macol Toxicol. 1999; 84: 107-9.
17 Jonderko G, Jonderko K, Marcisz C,
Kotulska A. Effect of cimetidine and ranitidine
on absorption of [125I]levothyroxine admi-
nistered orally. Zhongguo Yao Li Xue Bao.
1992; 13: 391-4.
18 Bergman F, Halvorsen P, van der Linden W.
Increased excretion of thyroxin by feeding
activated charcoal to Syrians hamsters. Acta
Endocrinol (Copenh). 1967; 56: 521-4.
19 Singh N, Wesler SL, Hershman JM. The acute
effect of calcium carbonate on the intestinal
absorption of levothyroxine. Thyroid. 2001;
11: 967-71.
20 Leger CS, Ooi TC. Ferrous fumarate-induced
malabsorption of thyroxin. Endocrinologist.
1999: 493-5.
21 Van der Heijden JT, Krenning EP, van Toor H,
Hennemann G, Docter R. Three compartmen-
tal analyss of effects of D-propanolol on thy-
roid hormons kinetics. Am J Physiol. 1988;
255: E80-6.
22 Demke DM. Drug interaction between thyro-
xine and lovastatin. N Engl J Med. 1989; 321:
1341-2.
23 Kisch E, Segall HS. Interaction between sim-
vastatin and L-thyroxine. Ann Intern Med.
2005; 143: 547.
24 Fdigge J, Dluhy RG. Amiodarone-induced ele-
vation of thyroid stimulating hormone in
patients receiving levothyroxine for primary
hypothyroidism. Ann Intern Med. 1990; 113:
553-5.
25 Mishell DRJr., Colodny SZ, Swanson LA. The
effects of an oral contraceptive on tests of
thyroid function. Fertil Steril. 1969; 20:
335-9.
26 Siraj ES, Gupta MK, Reddy SS. Raloxifène cau-
sing malabsorption of levothyroxine. Ann
Intern Med. 2003; 163: 1367-70.
27 Nolan SR, Self TH, Norwood JM. Interaction
between Rifampin and levothyroxine. South
Med J. 1999; 92: 529-31.
28 Gaskill CL, Burton SA, Gelens HC, Ihle SL,
Miller JB, Shaw DH et al. Changes in serum
thyroxin and thyroid-stimulating hormone
concentrations in epileptic dogs receiving
phenobarbital for one year. J Vet Pharmacol
Ther. 2000; 23: 43-9.
29 Schroder van der Elst JP, van der Heide D.
Effects of 5,5’-diphenylhydantoin on thyro-
xine and 3,5,3’triodothyronin concentrations
in several tissues of the rat. Endocrinology.
1990; 126: 186-91.
30 De luca F, Arrigo T, Pandullo E, Siracusano MF,
Benvenga S, Trimarchi F. Changes in thyroid
function tests induced 2 month carbamaze-
pine treatment in L-thyroxin substituted
hypothyroid children. Eur J Pediatr. 1986;
145: 77-9.
31 De Groot JW, Zonnenberg BA, Plukker JT,
van der Graaf WT, Links TP. Imatinib induces
hypothyroidism in patients receiving levothy-
roxine. Clin Pharmacol Ther. 2005; 78: 433-8.
32 McCowen KC, Garber JR, Spark R. Elevated
serum thyrotropine in thyroxine-treated
patients with hypothyroidism given sertra-
line. N Engl J Med. 1997; 337: 1010-1.
33 Conrad SC, Chiu H, Silverman BF. Soy formula
complicates management of congenital
hypothyroidism. Arch Dis Child. 2004; 89:
1077.
34 Choe W, Hays MT. Absorption of oral thyro-
xine. Endocrinologist. 1995; 5: 222-8.
35 Geatti O, Barkan A, Turrin D, Orsolon PG,
Shapiro B. L-thyroxine malabsorption due to
the injection of herbal remedies. Thyroido-
logy. 1993; 5: 97-102.
36 Chopra IJ, Baber K. Treatment of primary
hypothyroidism during pregnancy: is there
an increase in thyroxine dose requirement
in pregnancy? Metabolism. 2003; 52: 122-8.
37 Danzi S, Klein I. Thyroid hormone and the
cardiovascular system. Minerva Endocrinol.
2004; 29: 139-50.
38 Junglee NA, Scanlon MF, Rees DA. Increasing
thyroxine requirements in primary hypothy-
roidism: Don’t forget the urinalysis. J Postgrad
Med. 2006; 52: 201-3.
39 Centanni M, Gargano L, Canettieri G,
Viceconti N, Franchi A, Delle Fave G et al.
Thyroxine in goiter, Helicobacter pylori infec-
tion and chronic gastritis. N Engl J Med. 2006;
17: 1787-95.
Molines L, Fromont I, Morlet-Barla N, Nogueira JP, Valéro R, Vialettes B
tome 36 > n° 10 > octobre 2007 > cahier 1
1394
1
/
5
100%