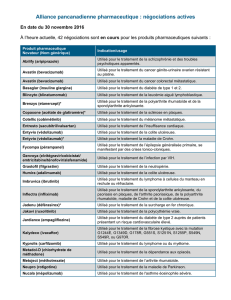
Rash d`origine immunologique

1
Les autorités de santé de l’Union Européenne ont assorti la mise sur le marché
du médicament OPDIVO® de certaines conditions. Le plan obligatoire de
minimisation des risques en Belgique, dont cette information fait partie, est
une mesure prise pour garantir une utilisation sûre et efficace du médicament
OPDIVO® (RMA version 10/2015).
OPDIVO®
(nivolumab)
Injection pour perfusion intraveineuse
Ce médicament fait l’objet d’une surveillance supplémentaire
Guide de Gestion des Effets Indésirables
Ce matériel ne contient pas toutes les informations. Pour une information complète, lisez
attentivement le Résumé des Caractéristiques du Produit (RCP) avant de prescrire (et/ou
d’utiliser et/ou de délivrer) OPDIVO®.
Le texte complet et actualisé de ce RCP est disponible sur le site www.afmps.be, rubrique
«NOTICE et RCP d’un médicament »

2
But de ce matériel (RMA ou Risk Minimisation Activities)
Cette information fait partie du plan de gestion des risques en Belgique, qui met du matériel
d’information à la disposition des professionnels de la santé (et des patients). Ces activités
additionnelles de minimisation des risques ont pour but une utilisation sûre et efficace
d’OPDIVO® et doivent comporter les parties importantes suivantes :
Matériel d'éducation destiné aux médecins
Carte d'alerte patient
Le matériel d'éducation destiné aux médecins doit contenir:
Le Résumé des Caracteristiques du Produit
Un guide de gestion des effets indésirables
Le Guide de Gestion des Effets Indésirables doit contenir les éléments clefs suivants:
Information pertinente (par exemple gravité, sévérité, fréquence, délai de survenue,
réversibilité des EI si applicable) pour les problèmes de tolérances suivants:
o Pneumopathie inflammatoire d'origine immunologique
o Colite d'origine immunologique
o Hépatite d'origine immunologique
o Néphrite d'origine immunologique ou dysfonctionnement de la fonction rénale
o Endocrinopathie d'origine immunologique
o Rash d'origine immunologique
o Autres effets indésirables d'origine immunologique
Détails sur la manière de minimiser les problèmes de tolérance au travers d'une surveillance et
d'une gestion appropriées
La carte d'alerte patient doit contenir les éléments clefs suivants:
Que le traitment par OPDIVO est susceptible d'augmenter le risque de
o Pneumopathie inflammatoire d'origine immunologique
o Colite d'origine immunologique
o Hépatite d'origine immunologique
o Néphrite d'origine immunologique ou dysfonctionnement rénal
o Endocrinopathie d'origine immunologique
o Rash d'origine immunologique
o Autres effets indésirables d'origine immunologique
Les signes ou symptômes d'un problème de tolérance et le moment où l'attention d'un
professionnel de santé est requise
Les coordonnées du médecin prescripteur d'OPDIVO
Il est important d’informer vos patients sur l’utilisation de cette carte d’alerte. Cette carte doit être
préalablement complétée avec vos coordonnées.
2

3
3
Explorez les sections qui suivent pour en apprendre
davantage sur la prise en charge des effets indésirables
d'origine immunologique :
Qu'est-ce que nivolumab ?
Reconnaître et prendre en charge les effets indésirables liés au traitement
Pneumopathie inflammatoire d'origine immunologique
Colite d'origine immunologique
Hépatite d'origine immunologique
Néphrite d'origine immunologique ou dysfonctionnement de la fonction rénale
Endocrinopathie d'origine immunologique
Rash d'origine immunologique
Autres effets indésirables d’origine immunologique
Détails sur la manière de minimiser les problèmes de tolérance au travers d'une surveillance
et d'une gestion appropriées

4
OPDIVO® est indiqué en monothérapie dans le traitement des patients adultes atteints d'un
mélanome avancé (non résécable ou métastatique).
OPDIVO® est indiqué dans le traitement des patients adultes atteints d'un cancer bronchique non-à-
petites cellules (CBNPC) de type épidermoïde localement avancé ou métastatique après une
chimiothérapie antérieure.
Qu'est-ce que nivolumab ?
Nivolumab est un anticorps monoclonal humain (HuMAb) de type immunoglobuline G4 (IgG4), qui se
lie au récepteur PD-1 (programmed death-1) et bloque son interaction avec PD-L1 et PD-L2. Le
récepteur PD-1 est un régulateur négatif de l'activité des cellules T, et il a été démontré qu'il est
impliqué dans le contrôle de la réponse immunitaire des cellules T. La liaison du PD-1 avec les ligands
PD-L1 et PD-L2, qui sont exprimés sur les cellules présentatrices de l'antigène et peuvent être
exprimés par les cellules tumorales ou par d'autres cellules du micro-environnement tumoral,
entraîne une inhibition de la prolifération des cellules T et de la sécrétion de cytokines. Nivolumab
potentialise les réponses des cellules T, incluant les réponses antitumorales, par un blocage de la
liaison de PD-1 aux ligands PD-L1 et PD-L2. Dans des modèles syngéniques chez la souris, le blocage
de l'activité du PD-1 a entraîné une diminution de la croissance de la tumeur.
Effets indésirables fréquents
• Dans l'ensemble de données cumulées issues de deux études de phase 3 sur le mélanome
(CA209066 et CA209037), les effets indésirables les plus fréquents (≥ 10 %) incluaient fatigue, rash,
prurit, diarrhée et nausées*1
• Dans l'ensemble des données poolées de deux études dans le CBNPC de type épidermoïde
(CA209017 et CA209063), les effets indésirables les plus fréquents (≥ 10% des patients) ont été :
fatigue, diminution de l’appétit et nausées. †²
*CA209037 – Étude de phase III randomisée en ouvert chez des patients ayant progressé sous ou après traitement par
ipilimumab et, dans le cas de mutation BRAFV600 positif, ayant également progressé sous ou après traitement par inhibiteur
de BRAF. Un total de 405 patients étaient randomisés pour recevoir soit nivolumab (n = 272) administré de façon
intraveineuse pendant 60 minutes à raison de 3 mg/kg toutes les 2 semaines soit une chimiothérapie (n = 133) laissée à
l'appréciation de l'investigateur, soit par dacarbazine (1 000 mg/m2 toutes les 3 semaines) soit par carboplatine (AUC 6
toutes les 3 semaines) et paclitaxel (175 mg/m² toutes les 3 semaines).
1CA209066 – Étude de phase III randomisée en double aveugle chez des patients (âgés de 18 ans ou plus) naïfs de
traitement présentant un diagnostic confirmé de mélanome à gène BRAF de type sauvage de stade III ou IV, et affichant un
score de 0 ou 1 sur l'échelle de performance de l'Eastern Cooperative Oncology Group (ECOG). Un total de 418 patients
étaient randomisés pour recevoir soit nivolumab (n = 210) administré de façon intraveineuse pendant 60 minutes à raison
de 3 mg/kg toutes les 2 semaines, soit dacarbazine (n = 208) à raison de 1 000 mg/m2 toutes les 3 semaines.
† Données issues d’une étude clinique de phase III (CA209063). L’étude évaluait la tolérance et l'efficacité de
nivolumab 3 mg/kg en monothérapie chez 117 patients avec un CBNPC de type épidermoïde suite à une progression après
une chimiothérapie à base de sels de platine et au moins un autre traitement systémique.
4

5
² Les données sont issues d’une étude clinique de phase III (CA209017) évaluant la tolérance et l'efficacité de
nivolumab 3 mg/kg en monothérapie dans le traitement du CBNPC de type épidermoïde localement avancé ou
métastatique chez 272 patients dont la maladie avait progressé pendant ou après une première ligne de chimiothérapie à
base de sels de platine. Les patients ont été randomisés pour recevoir soit nivolumab à la posologie de 3 mg/kg (N = 135)
administré sur 60 minutes par voie intraveineuse, toutes les 2 semaines, soit docétaxel (N = 137) à la posologie de
75 mg/m2 toutes les 3 semaines
Voir section 5.1 du RCP pour l’information détaillée.
5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
1
/
24
100%