Rôle de la molécule immune CD3 dans le développement neuronal

1
UNIVERSITÉ DE NANTES
FACULTÉ DE MEDECINE
École doctorale BIOLOGIE SANTÉ
Année 2010 N° 27
Rôle de la molécule immune CD3 dans le
développement neuronal et les fonctions cérébrales
THÈSE DE DOCTORAT
Discipline : Sciences de la vie
Spécialité : Neurobiologie
Présentée
et soutenue publiquement par
ANGIBAUD Julie
Le 29 octobre 2010, devant le jury ci-dessous
Rapporteurs : Isabelle DUSART, Directeur de Recherche, Paris
Bruno GONZALEZ, Directeur de Recherche, Rouen
Examinateurs : Nelly NORAZ, Chargée de Recherche, Lyon
Patricia PARNET, Directeur de Recherche, Nantes
Directeur de Thèse: Hélène BOUDIN, Chargée de Recherche, Nantes

2
SOMMAIRE
TABLE DES ILLUSTRATIONS ............................................................................................................................... 5
ABREVIATIONS UTILISEES ................................................................................................................................. 7
AVANT PROPOS .............................................................................................................................................. 11
INTRODUCTION .............................................................................................................................................. 13
I. LE DEVELOPPEMENT NEURONAL ........................................................................................................... 14
A. NEUROGENESE ............................................................................................................................................. 14
1. Neurogenèse chez l’embryon ............................................................................................................... 14
2. Neurogenèse chez l’adulte ................................................................................................................... 15
a) La zone sous-ventriculaire des ventricules latéraux ......................................................................................... 16
b) La zone sous- ........................................................................................................ 17
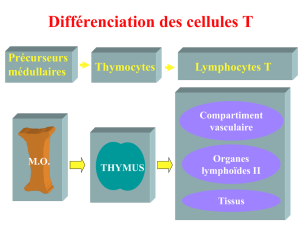
3. Rôle des molécules immunes dans la neurogenèse ............................................................................. 19
B. POLARISATION NEURONALE ............................................................................................................................. 20
1. Polarisation neuronale in vitro ............................................................................................................ 20
a) ................................................................................................................. 22
(1) ............................................... 23
(2) rites ................................... 24
b) Différentiation axonale .................................................................................................................................... 29
(1) Les grandes étapes de la spécification axonale ........................................................................................... 29
(2) Signalisation impliquée dans la différenciation axonale ............................................................................. 31
c) Différenciation dendritique .............................................................................................................................. 34
(1) Les grandes étapes de la différenciation dendritique ................................................................................. 34
(2) Signalisation impliquée dans la différenciation dendritique ....................................................................... 35
(3) Croissances axonale et dendritique............................................................................................................. 39
2. Polarisation neuronale in vivo ............................................................................................................. 41
a) Similitudes entre la polarisation in vivo et in vitro ........................................................................................... 42
b) Différences entre la polarisation in vitro et in vivo. ......................................................................................... 42
3. Rôle des molécules immunes dans la formation des prolongements neuronaux ................................ 43
C. LES SYNAPSES ............................................................................................................................................... 43
1. Structure et fonction des synapses ...................................................................................................... 44
2. La synapse excitatrice .......................................................................................................................... 45
a) Les récepteurs au glutamate ............................................................................................................................ 46
(1) Les récepteurs métabotropiques (mGluR) .................................................................................................. 47
(2) Les récepteurs ionotropiques (iGluR) .......................................................................................................... 47
b) ........................................................................................................................... 51
(1) Les protéines MAGUKs ................................................................................................................................ 51
(2) Les protéines Shank ..................................................................................................................................... 52
(3) Les protéines Homer ................................................................................................................................... 52
c) Les protéines kinases et phosphatases ............................................................................................................ 53
(1) La protéine CaMKII ...................................................................................................................................... 53
(2) Les protéines kinase PKA et PKC .................................................................................................................. 54
(3) Les protéines phosphatases PP1 et PP2B (calcineurine) ............................................................................. 55
3. Molécules du SI impliquées dans la fonction et l’homéostasie des synapses ...................................... 55
II. CONSEQUENCES DE L’EXPRESSION NEURONALE DES MOLECULES DU SYSTEME IMMUNITAIRE ............ 58
A. NEURODEVELOPPEMENT ................................................................................................................................ 58
1. Infections au cours de la grossesse ...................................................................................................... 58

3
2. Mutation des gènes du système immunitaire...................................................................................... 59
B. THERAPIE DIMMUNOINTERVENTION ................................................................................................................. 59
1. Cyclosporine A ..................................................................................................................................... 59
2. L’anticorps monoclonal de souris : OKT3 ............................................................................................. 60
III. CD3 : MOLECULE ADAPTATRICE DANS LES SYSTEMES IMMUNITAIRE ET NERVEUX CENTRAL ............... 62
A. STRUCTURE DU CD3ZETA ............................................................................................................................... 62
B. LES RECEPTEURS COUPLES A CD3 ET LES FONCTIONS ASSOCIEES. ........................................................................... 64
1. Le TCR (T cell receptor) ........................................................................................................................ 64
2. Les récepteurs des cellules NK ............................................................................................................. 65
3. Le récepteur CXCR4 .............................................................................................................................. 66
C. SIGNALISATION INTRACELLULAIRE DECLENCHEE PAR LACTIVATION DE CD3 ............................................................. 68
D. ROLE DU CD3 DANS LE SYSTEME NERVEUX CENTRAL........................................................................................... 69
OBJECTIFS DE LA THESE .................................................................................................................................. 72
ARTICLE I : THE IMMUNE SIGNALING MOLECULE CD3 PREVENTS NEURONAL CELL-FATE DECISION FROM
NEURAL PROGENITOR CELLS AND RESTRAINS NEURITOGENESIS IN NEWLY-BORN NEURONS THROUGH A
RHO-GEF VAV2 PATHWAY .............................................................................................................................. 74
ARTICLE II : THE SIGNALING ADAPTOR PROTEIN CD3 IS A NEGATIVE REGULATOR OF DENDRITE
DEVELOPMENT IN YOUNG NEURONS ........................................................................................................... 110
RESULTATS SUPPLEMENTAIRES .................................................................................................................... 124
DISCUSSION GENERALE ET PERSPECTIVES .................................................................................................... 149
BIBLIOGRAPHIE ............................................................................................................................................ 159
A .................................................................................................................................................................. 159
B ................................................................................................................................................................... 160
C ................................................................................................................................................................... 161
D .................................................................................................................................................................. 163
E ................................................................................................................................................................... 165
F ................................................................................................................................................................... 165
G .................................................................................................................................................................. 166
H .................................................................................................................................................................. 167
I .................................................................................................................................................................... 169
J ................................................................................................................................................................... 170
K ................................................................................................................................................................... 170
L ................................................................................................................................................................... 172
M ................................................................................................................................................................. 175
N .................................................................................................................................................................. 177
O .................................................................................................................................................................. 178
P ................................................................................................................................................................... 178
Q .................................................................................................................................................................. 180

4
R ................................................................................................................................................................... 180
S ................................................................................................................................................................... 182
T ................................................................................................................................................................... 186
U .................................................................................................................................................................. 187
V .................................................................................................................................................................. 187
W ................................................................................................................................................................. 188
X ................................................................................................................................................................... 189
Y ................................................................................................................................................................... 189
Z ................................................................................................................................................................... 189

5
Table des illustrations
........................ 11
Figure 2: Neu ................................................................................. 15
Figure 3: Neurogenèse adulte dans le cerveau de mammifères représentée par un schéma du
cerveau adulte de rat. ........................................................................................................................... 16
Figure 4: Neurogenèse dans la zone sous-ventriculaire (ZSV) adulte. .................................................. 17
Figure 5: Neurogenèse dans la zone sous-granulaire (ZSG) dans le gyrus dentelé
adulte..................................................................................................................................................... 18
Figure 6: Etablissement de la polarisation des neurones hippocampiques in vitro. ............................. 21
Figure 7: Etapes clés de la polarisation neuronale. ............................................................................... 22
.................................... 22
Figure 9: Structure du cône de croissance. ........................................................................................... 23
............................. 24
Figure 11: Régulation des protéines Rho GTPases. ............................................................................... 27
................... 28
Figure 13: R .. 28
Figure 14: Modèle de la spécification axonale au cours de la polarisation neuronale. ........................ 30
Figure 15: Voies de signalisation impliquées dans la spécification axonale au cours de la polarisation
neuronale. ............................................................................................................................................. 31
Figure 16: Voies de signalisation impliquées dans la spécification dendritique au cours de la
polarisation neuronale. ......................................................................................................................... 36
.................................................................... 40
Figure 18: Polarisation neuronale in vivo. ............................................................................................. 42
.............................. 45
.................................................................................... 46
Figure 21: Représentation schématique du récepteur AMPA et des protéines qui régulent son
accumulation au niveau des synapses. ................................................................................................. 48
Figure 22: Représentation de la chaîne
le TCR. .................................................................................................................................................... 62
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
 161
161
 162
162
 163
163
 164
164
 165
165
 166
166
 167
167
 168
168
 169
169
 170
170
 171
171
 172
172
 173
173
 174
174
 175
175
 176
176
 177
177
 178
178
 179
179
 180
180
 181
181
 182
182
 183
183
 184
184
 185
185
 186
186
 187
187
 188
188
 189
189
 190
190
 191
191
1
/
191
100%