Chapitre 9 : Réactivité des alcools.

GROSSHENY Laurent
Lycée J-B Schwilgué - Sélestat
Première S
Chapitre 09
Initiation à la réactivité des composés organiques.
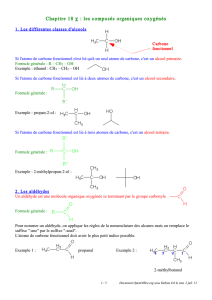
I. Les familles de composés organiques.
Ces composés sont caractérisés par l'existence d'un groupement fonctionnel dans leur molécule.
1. Composés oxygénés
groupe se situant en bout de chaîne : aldéhyde
groupe contenu dans la chaîne carbonée : cétone
groupe - OH fixé sur un atome de carbone tétraédrique : alcool
groupe se situant en bout de chaîne : acide carboxylique
Exemples
2. Composés halogénés
groupes - F - Cl - Br - I liés à un atome de carbone
Exemples
3. Amine primaire
groupe - NH 2 lié à un atome de carbone
Exemples
C
O
H
O
C
C
O
OH
O
H
propanal
un aldéhyde
une cétone
butan-2-one
un alcool
OH
éthanol
O
OH
un acide carboxylique
acide propanoïque
O
2-fluoropentane
F
tribromométhane
Cl
Cl
2,3-dichlorobutane
Br
Br
Br
I
iodobenzène
NH2
1-aminoéthane
NH2
2-amino-2-méthylpropane
O
NH2
H
acide 2-aminopropanoïque ou alanine

GROSSHENY Laurent
Lycée J-B Schwilgué - Sélestat
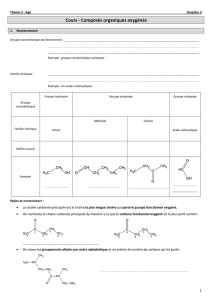
II. La réactivité des alcools
1. Réaction de substitution.
Une réaction de substitution consiste à remplacer un groupement par un autre.
Un alcool réagissant avec de l’acide chlorhydrique concentré donne un dérivé halogéné au
cours d’une réaction de substitution.
Exemple
OH 2ClCHCHClOHOHCHCH 223323
2. Réaction d’élimination.
L’élimination d’une molécule d’eau lors d’une réaction correspond à une déshydratation.
La déshydratation d’un alcool conduit à un alcène.
Exemple
sulfurique acide
OHCHCH 23
OHCHCH 222
3. Réaction d’oxydation.
3.a) Oxydation totale par l’air (combustion)
Comme la plupart des espèces chimiques organiques, les alcools peuvent brûler dans l’air.
CnH2n+1OH + ( 3/2).n O2
n CO2 + (n+1) H2O
C’est une réaction exothermique qui libère une grande quantité d’énergie. Ce qui explique
l’utilisation des alcools comme combustibles (alcool à brûler) ou carburant.
3.b) Oxydation ménagée d’un alcool
La chaîne carbonée de la molécule est préservée. Seul le groupement fonctionnel alcool est
transformé.
l’alcool primaire est oxydé en aldéhyde puis en acide carboxylique si les conditions de
l’expérience le permettent
l'alcool secondaire est oxydé en cétone
l'alcool tertiaire n'est pas oxydable
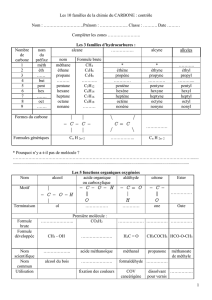
Rappels :
Un alcool est dit :
primaire si l'atome de carbone fonctionnel (auquel est lié le groupement OH) est lié à zéro ou
un atome de carbone
secondaire si l'atome de carbone fonctionnel est lié à deux atomes de carbone
tertiaire si l'atome de carbone fonctionnel est lié à trois atomes de carbone
Exemples d’oxydations :
Oxydation d'un alcool primaire par les ions permanganate
2* OH4Mn e5H8MnO 2
2
4
5* e2H2CHOCH OHCHCH 323
OH8Mn 2CHOCH 5H 6MnO 2OHCHCH 5 2
2
3423
propan-1-ol
un alcool primaire
OH
un alcool secondaire
OH
propan-2-ol
un alcool tertiaire
OH
2-méthylpropan-2-ol

GROSSHENY Laurent
Lycée J-B Schwilgué - Sélestat
Oxydation d'un alcool secondaire par les ions permanganate
2* OH4Mn e5H8MnO 2
2
4
5* e2H2CHCOCH CHCHOHCH 3333
OH8Mn 2CHCOCH 5H 6MnO 2CHCHOHCH 5 2
2
33433
3.c) Utilisation de l’oxydation d’un alcool.
Dans l'industrie, on doit faire attention au prix de développement d’une molécule.
Quelle molécule de base choisir ? Un aldéhyde dont le prix est de 200 euros pour 1g et où un alcool
qui coute 10 euros pour 1kg que l’on peut utiliser pour synthétiser l’aldéhyde précédent ?
Dans l'industrie il faut aussi tenir compte de la disponibilité. Si la molécule n'existe pas il faut la
synthétiser. Si elle existe, il faut voir le prix et le délai de livraison (s’il faut attendre 1 mois et que
cela est urgent ... il faut se débrouiller pour trouver une solution).
Exemple simple : la lampe Berger.
C'est un récipient contenant des alcools, dans lequel trempe une mèche. Cette mèche est en contact
d'un fil de cuivre, qu'on chauffe (d'abord avec une flamme, après c'est autoentretenu).
Les alcools grimpent dans la mèche. Au contact du cuivre, ils s'oxydent avec l'oxygène de l'air pour
donner des aldéhydes, responsables de la bonne odeur
III. Conclusion sur la réactivité des alcools.
1. Un exemple : le méthanol.
Le méthanol permet de préparer de nombreux produits.
– Par action du chlorure d'hydrogène, production de chlorométhane (très utilisé comme
intermédiaire de synthèse ou solvants).
– Par oxydation ménagée du dioxygène, production :
d'acide méthanoïque HCOOH utilisé comme conservateur
de méthanal (formol) HCHO utilisé pour les résines, colles, mousses synthétiques et
produits cosmétiques.
– Par addition de monoxyde de carbone, production d'acide éthanoïque (acide acétique) utilisé dans
les vernis, fibres textiles et adhésifs.
2. Passage d’un groupe caractéristique à un autre
Les réactions d’oxydation, d’élimination et de substitution montrent qu’il est possible de réaliser le passage
d'un groupe caractéristique à un autre groupe. Ces réactions sont réversibles. Ainsi, le chimiste peut, par un
choix judicieux des réactifs et des conditions expérimentales, synthétiser la molécule de son choix.
CH3-CH3
CH2 = CH2
CH3-CH2OH
CH3-CH2Cl
CH3-CHO
CH3-COOH
vapocraquage
hydrogénation
b
hydratation
déshydratation
b
substitution
oxydation
réduction
oxydation
réduction
1
/
3
100%