AA_Article B

Vol. 107 - Février 2013 Julien CALAFELL…
Détermination du type d’une réaction
en chimie organique
par Julien CALAFELL
Lycée Bellevue - 31031 Toulouse Cedex 4
Françoise MILON
Université Paul Sabatier - 31062 Toulouse Cedex 9
et André GILLES
31320 Aureville
RÉSUMÉ
Après avoir revu les définitions de l’IUPAC (Union internationale de chimie pure et
appliquée) des réactions d’addition, d’élimination et de substitution, nous modéliserons
ces réactions et étudierons des exemples. Dans une deuxième partie, nous essaierons de
dégager des règles simples permettant d’attribuer à certaines réactions le qualificatif
nucléophile ou électrophile.
INTRODUCTION
Dans les nouveaux programmes de chimie organique de terminale scientifique, il est
demandé aux élèves de classer les réactions en trois catégories : addition, substitution et
élimination. On peut noter que les réactions acide base et redox, classiques en chimie
générale, sont deux autres catégories également présentes en chimie organique. Cet exer-
cice est délicat, car on remarque que certains élèves de licence ou de CPGE (Classes
préparatoires aux grandes écoles) ont parfois des difficultés à classer les réactions propo-
sées. Les discussions que nous avons eues sur le sujet lors des JIREC (Journées de l’in-
novation et de la recherche dans l’éducation en chimie) 2012 à Toulouse montrent que cette
classification est loin d’être évidente.
Le type de réaction en chimie organique est généralement qualifié par un adjectif
(électrophile, nucléophile, radicalaire, etc.). Ce n’est pas, heureusement, une exigence du
programme de terminale, mais cela pourra se rencontrer dans les documents donnés aux
élèves pour analyse. Nous aborderons donc cette question dans un deuxième temps.
Nous allons commencer par donner les définitions de l’IUPAC avant d’en discuter
la transposition qui peut être envisagée dans l’enseignement.
U N I O N D E S P R O F E S S E U R S D E P H Y S I Q U E E T D E C H I M I E 129

Détermination du type d’une réaction en chimie organique Le Bup n° 951
1. LES DÉFINITIONS DE L’IUPAC
On trouve ces définitions sur Internet dans le Goldbook en anglais :
http://goldbook.iupac.org/
Il a été traduit en français par Jean-Claude RICHER et édité par Tec & Doc. Voici quelques
extraits de : Compendium de terminologie chimique [1].
1.1. Équation d’une réaction chimique
« Représentation symbolique d’une réaction chimique dans laquelle on indique les
entités réagissantes sur la partie gauche et les entités produites sur la partie droite. Les
coefficients placés près des symboles et des formules des entités sont les valeurs abso-
lues des nombres stœchiométriques. On utilise divers symboles pour relier les réactifs et
les produits ; ils ont les significations suivantes : = pour une réaction stœchiométrique ;
pour une réaction qui globalement se déplace vers la droite ; pour une réaction qui
va dans les deux sens ; pour une réaction équilibrée. ».
Remarque :L’avant-dernier symbole caractérise deux réactions inverses dont les
vitesses ne sont pas égales alors que le dernier symbole caractérise les deux réactions à
l’état d’équilibre. Dans l’écriture des réactions chimiques ci-dessous ces conventions ne
sont pas toujours utilisées. En particulier, il faudrait utiliser plus souvent les doubles
flèches dans les mécanismes où les étapes sont élémentaires en vertu du principe de
réversibilité microscopique.
1.2. Réaction élémentaire
Réaction pour laquelle on n’a pas détecté (ou il n’est pas nécessaire de suggérer
l’existence) d’intermédiaire réactionnel pour décrire la réaction chimique au niveau molé -
culaire. On fait l’hypothèse qu’une réaction élémentaire se produit en une seule étape
réactionnelle et qu’elle se produit par un seul état de transition.
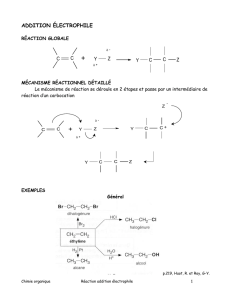
1.2.1. Réaction d’addition
« Réaction chimique entre deux ou trois entités moléculaires conduisant à un seul
produit réactionnel contenant tous les atomes de tous les réactifs, avec formation de deux
liaisons chimiques et réduction globale de la multiplicité des liaisons dans au moins un
des réactifs. Le processus inverse est une réaction d’élimination. L’addition peut se pro -
duire sur un seul site (addition α, 1/1/addition), sur deux sites adjacents (1/2/addition) ou
sur deux sites qui ne sont pas adjacents (1/3/- ou 1/4/additions, etc.). Par exemple :
(a) H++ Br –+ (CH3)2C=CH2(CH3)2CBr-CH31/2/addition.
(b) Br2+ CH2=CH-CH=CH2BrCH2-CH=CH-CH2Br (1/4/addition)
ou BrCH2CH(Br)-CH=CH2(1/2/addition).
Si le réactif ou la source des addends de l’addition ne sont pas spécifiés, on parle alors
d’une transformation d’addition. ».
"
D
?
"
"
U N I O N D E S P R O F E S S E U R S D E P H Y S I Q U E E T D E C H I M I E130

Vol. 107 - Février 2013 Julien CALAFELL…
1.2.2. Addition
« 1. Se réfère à une réaction d’addition ou à une transformation d’addition.
2. Terme flou pour désigner la formation d’un adduit (pour un exemple, voir acide de
Lewis).
3. Terme flou pour désigner toute association ou fixation. ».
1.2.3. Adduit
« Espèce chimique nouvelle, AB, dont chaque entité moléculaire est formée par
combinaison directe de deux entités moléculaires distinctes, A et B, avec changement de
connectivité, mais pas de perte, d’atomes provenant des fragments A et B. Des stœchio-
métries différentes de 1:1 sont aussi possibles, par exemple, un bis-adduit (2:1). Quand
A et B sont des groupes appartenant à la même entité moléculaire, il peut se former un
“ adduit intramoléculaire ”. C’est un terme général qui devrait être utilisé, chaque fois
qu’il est approprié, de préférence à celui moins explicite de complexe. On l’utilise aussi
spécifiquement pour les produits d’une réaction d’addition. Pour des exemples, voir :
adduit de Lewis ; adduit-pi… ».
Exemples d’adduits
Commentaires
L’IUPAC distingue « Addition » et « Réaction d’addition ». La définition qui nous
intéresse est celle de la « réaction d’addition ». Les exemples donnés montrent que cette
définition s’applique à un bilan et non à une réaction élémentaire, bien que cela ne soit
pas précisé. En conséquence la réaction élémentaire d’un acide de Lewis comme Cl+ou
H+sur une double liaison C=C n’est pas une « réaction d’addition », mais une « addition »
au sens flou du terme selon l’IUPAC !
Reprenons le premier exemple :
(a) H++ Br –+ (CH3)2C=CH2(CH3)2CBr-CH3
Ce bilan se décompose en deux étapes élémentaires dont la première est :
®H++ (CH3)2C=CH2(CH3)2C+-CH3est une « addition » ou une « réaction de trans-
fert de proton », mais pas une « réaction d’addition » puisque les deux liaisons sim -
ples C-H et C-Br ne sont pas encore formées. Le carbocation intermédiaire peut être
qualifié d’adduit.
"
"
U N I O N D E S P R O F E S S E U R S D E P H Y S I Q U E E T D E C H I M I E 131

Détermination du type d’une réaction en chimie organique Le Bup n° 951
®La deuxième étape est l’addition de l’ion bromure et du carbocation.
C’est l’ensemble des deux étapes qui constitue la « réaction d’addition ». Notons qu’on
peut aussi qualifier ce bilan de réaction d’oxydoréduction interne ou dismutation puisque
le C bromé est oxydé et le C hydrogéné est réduit.
1.2.5. Réaction de substitution
« Réaction élémentaire, ou réaction par étapes, au cours de laquelle un atome ou un
groupe d’une entité moléculaire est remplacé par un autre atome ou groupe. Par exemple :
CH3Cl + OH –CH3OH + Cl–».
Commentaire
L’IUPAC précise que cette définition s’applique à une réaction élémentaire ou à une
réaction par étape. Il n’est pas dit que cela s’applique à un bilan stœchiométrique. Si cette
interprétation très restrictive et contraignante est correcte, nous ne pouvons donc pas qua -
lifier de « réaction de substitution » une réaction dont on ne connaît que le bilan stœchio-
métrique, mais cela doit se faire en examinant la suite des étapes de la réaction. Nous verrons
que cela a d’énormes conséquences par la suite.
1.2.6. Réaction de transfert de proton
« Réaction chimique dont l’essentiel est le transfert intermoléculaire ou intramolé-
culaire d’un hydron (proton) d’un site liant à un autre. Par exemple :
CH3CO2H + (CH3)2C=O CH3CO2–+ (CH3)2C=O+-H » (1)
1.2.6. Oxydation
« 1. Enlèvement global et total d’un ou de plusieurs électrons d’une entité molécu-
laire (appelé aussi “ désélectronation ”).
2. Augmentation du nombre d’oxydation de tout atome dans un substrat.
3. Gain d’oxygène et/ou une perte d’hydrogène par un substrat organique.
Les critères (1) et (2) s’appliquent à toutes les oxydations ; le critère (3) s’applique
souvent, mais il n’est pas toujours facile de le démontrer. […] ».
1.2.7. Réduction
« Transfert total d’un ou de plusieurs électrons à une entité moléculaire (on dit aussi
“ électronation ”) et, plus généralement, le contraire des processus décrits sous oxydation
(2) et (3). ».
"
"
U N I O N D E S P R O F E S S E U R S D E P H Y S I Q U E E T D E C H I M I E132
(1) L’exemple ci-dessus, donné par l’IUPAC, concerne une réaction de l’acétone en milieu acide éthanoïque.
On pourrait bien entendu donner de nombreux exemples en solution aqueuse.

Vol. 107 - Février 2013 Julien CALAFELL…
2. MODÉLISATION
Les trois types de réactions peuvent être modélisés, mais ce n’est pas sans risque.
®Réactions d’addition (s’applique à un bilan) :
A=B + C-D C-A-B-D ou A=B + C + D C-A-B-D
Il y a bien formation de deux liaisons simples et diminution de la multiplicité d’une
liaison.
Variantes : A≡B + C-D C-A=B-D ou A≡B + 2 C-D C2A-BD2
®Réactions d’élimination :
C-A-B-D A=B + C-D ou C-A-B-D A=B + C + D
®Réaction de substitution (s’applique à une réaction élémentaire ou par étapes connues,
mais non à un bilan dont le mécanisme est inconnu). L’équation A+B C+Dne
suffit donc pas à définir une substitution. Il faut s’assurer qu’un atome ou groupe
d’atomes de A est remplacé intégralement par un atome ou groupe d’atomes de B.
Variantes : A + B-C A-B + C
ou A-B + C-D A-C + B-D (ou +B +D).
3. PROBLÉMATIQUE
Au cours d’une réaction chimique, il y a souvent intervention d’au moins deux com -
posés. La détermination de la catégorie de réaction impliquée est ambiguë.
Exemple
La réaction de formation de Pcorrespond-elle à une addition (nucléophile) des
composés A et B ou à une substitution (électrophile) sur le composé A?
Cette réaction correspond en tout point à la définition de la « réaction d’addition »:
la liaison double C=O de B devient une liaison simple et on forme deux liaisons simples
C-C et O-Mg. Considérer que cette réaction est une substitution du groupe -MgBr par
–CH2OMgBr n’est pas correct pour plusieurs raisons :
– elle correspond au modèle de l’addition A=B + C-D C-A-B-D ;
– le groupe –CH2OMgBr qui remplacerait le groupe –MgBr n’est pas contenu entière-
ment dans B donc cela ne peut être une substitution d’après les exemples de l’IUPAC.
L’examen approfondi permet de donner une réponse univoque à la question posée…
"
"
"
"
"
"
"
"
"
(1)
"
U N I O N D E S P R O F E S S E U R S D E P H Y S I Q U E E T D E C H I M I E 133
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
1
/
18
100%