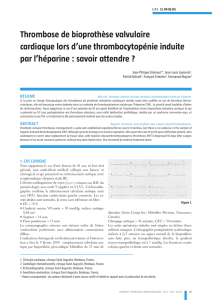
Valve cardiaque transcathéter (SAPIEN VCT)

TECHNOLOGIE MÉDICALE Valve cardiaque transcathéter (SAPIEN VCT)
DOMAINE Cardiaque, Vasculaire
FONCTION Bloc opératoire/Radiologie diagnostique et thérapeutique
DATE : 15 Mars 2012
Source :
Source : http://www.edwards.com/fr/products/transcathetervalves/pages/sapienthv.aspx
CONTEXTE
Les maladies valvulaires cardiaques sont un important problème de santé publique liées à la fois
au vieillissement de la population et à un pronostic de morbidité et de mortalité élevé. La maladie
valvulaire dégénérative la plus fréquente du monde industrialisé est la sténose aortique
calcifiée(SAC).
Une sténose aortique est un rétrécissement de l’ouverture de la valvule aortique dans le cœur qui
limite la quantité de sang qui passe du ventricule gauche dans l’aorte. Une sténose aortique est
caractérisée par une calcification ou une accumulation de dépôt de calcium sur les feuillets de la
valve aortique. Ce phénomène diminue la flexibilité des valves et empêche leurs mouvements
d’ouverture et de fermeture, obstruant le débit de sang riche en oxygène vers l’organisme.
Le remplacement valvulaire aortique percutané (RVAP) ou transcathéter est une technique qui a
été appliquée pour la première fois dans un cadre clinique en 2002 en France, et qui évolue
rapidement. Elle est actuellement proposée en Europe et en Amérique du nord comme alternative
au remplacement valvulaire aortique chirurgical conventionnel chez les patients atteints de
sténose aortique symptomatique sévère.
Edwards Lifesciences collaboré étroitement avec le professeur Alain Cribier (Rouen, France) qui
a réalisé la première implantation percutanée chez l’homme d’une valve aortique prothétique
déployée par ballonnet en 2002. Cette collaboration a abouti au développement par la société
Edwards de la valve Edwards SAPIEN, qui a reçu le marquage Conformité Européenne (CE) en
2007.
Le 22 juin 2011, Santé Canada a délivré à Edwards Lifesciences LLC une homologation avec
conditions de classe IV portant sur l’instrument médical valve cardiaque transcathéter Edwards
SAPIEN, modèle 9000TFX (ci-après appelée SAPIEN VCT).

DESCRIPTION
SAPIEN VCT est une bioprothèse cardiaque qui est implantée par voie transfémorale ou
par voie transapicale. SAPIEN VCT est conçue pour fonctionner d’une manière
semblable à une valvule sigmoïde endogène dans la prévention du reflux vers le
ventricule gauche, lors de la diastole, en provenance de l’aorte.
SAPIEN VCT, modèle 90000TFX, comporte une valve péricardique à trois ailettes
brochées à l’intérieur d’un cadre de filet extensible en acier inoxydable, ayant une jupe en
polyester. La valve à trois ailettes est fabriquée en se servant de trois sections de tissu de
péricarde de bovin. SAPIEN VCT se vend en deux tailles, 23 mm et 26 mm. D’autres
composantes de SAPIEN VCT comprennent une sertisseuse, un cathéter à ballonnet et le
dispositif d’administration.
SAPIEN VCT combine la technologie des sentes expansibles par ballonnet à celles des
valvules bioprothétique. Cette valvule cardiaque est destinée à être implantée par
transcathéter chez les patients présentant une sténose aortique sévère. Avant son
implantation, la bioprothèse est soigneusement montée et sertie sur cathéter de mise en
place par ballonnet à l’aide d’un dispositif de sertissage spécialement conçu à cet effet.
La bioprothèse est insérée à travers la pointe du ventricule gauche, puis mise en place au
niveau de la valvule aortique sténosée. La bioprothèse est placée et déployée dans la
valvule native sténosée et le système de mise en place à ballonnet est ensuite retiré.
Cette méthode peu effractive est destinée à être utilisée sous anesthésie générale au
moyen de techniques stériles, sous échocardiographie et guidage radioscopique.
BESOINS ACTUELS ET TENDANCES
L’implantation de SAPIEN VCT s’adresse uniquement aux patient atteints d’un rétrécissement
aortique grave, qui ne peuvent pas être opérés en raison des risques chirurgicaux très élevés que
comporterait une chirurgie à cœur ouvert, et dont les symptômes ne peuvent plus être améliorés
par le simple traitement médical.
IMPACTS FONCTIONNELS
- L’implantation de SAPIEN VCT, pratiquée dans une salle de cathétérisme cardiaque est
réalisée sous anesthésie locale ou générale.
- Quelle que soit la voie d’abord, en cas d’intervention en salle de cathétérisme cardiaque, la
salle doit être conditionnée comme un bloc opératoire de chirurgie cardio-vasculaire en termes
d’asepsie et un site d’anesthésie conforme à celui d’un bloc doit être disponible.
- En cas d’intervention en bloc opératoire, la qualité de l’imagerie doit être la plus proche de
celle d’une salle de cathétérisme cardiaque.
- En fonction de l’existence ou non de complications, les patients sont orientés en unité de
soins intensifs cardiologique ou en réanimation

IMPACTS ORGANISATIONNELS
- Durant l’implantation valvulaire aortique par cathéter, doivent être présents en salle
d’intervention un anesthésiste-réanimateur formé à la chirurgie cardiaque, un infirmier
anesthésiste et deux opérateurs qualifiés dont au moins un cardiologue interventionnel et en plus
doivent être disponible un cardiologue échographiste et un chirurgien cardio-vasculaire et
thoracique ou un chirurgien vasculaire.
- Les plateaux techniques de cardiologie interventionnelle et de chirurgie cardiaque doivent être
regroupés sur le même site et dans le même bâtiment, au cas où une conversion en urgence serait
nécessaire.
IMPACTS ÉCONOMIQUES
- Le cout d’achat de la valve cardiaque transcathéter (SAPIEN VCT) est 23 000 $CAN
- La procédure de l’implantation valvulaire aortique : environ 57 000 $CAN
IMPACTS TECHNOLOGIQUES
- Salle d’opération avec arceau de fluoroscopie fixe
- Salle d’opération avec arceau de fluoroscopie mobile
IMPACTS IMMOBILIERS
- Configuration des salles pour les procédures de l’implantation valvulaire aortique par cathéter
au bloc opératoire avec technologie d’imagerie appropriée.
IMPACTS SUR LA CLIENTÈLE
- Diminution de la durée d’hospitalisation
- Rétablissement plus rapide qu’avec les méthodes traditionnelles
NORMES EN VIGUEUR
CAN/CSA-Z11135-1-09
CAN/CSA-ISO 14971-07
CAN/CSA-Z17664-06 (R2011)
ASTM F138-08
ASTM E8
ASTM F2052-00
ASTM F2119-01
ASTM F 720-81(2007)
ASTM F2129-03
NF EN 556-2
NF EN 1041

NF EN 980
NF EN 12006-2/IN1 Juin 2009
NF EN 14299: 2004
NF EN 20594-1 Décembre 1993
RÉFÉRENCES
[1]. Rapport groupe de travail du réseau Québécois de cardiologie tertiaire, (page consultée le 27
février 2012). Remplacement valvulaire aortique par cathéter, [En ligne]. Adresse URL:
http://publications.msss.gouv.qc.ca/acrobat/f/documentation/2010/10-906-03.pdf.
[2]. EDWARDS LIFESCIENCES, (page consultée le 27 février 2012). Sommaire des motifs de
décision (SMD) EDWARDS SAPIEN TRANSCATHETER HEART VALVE Edwards
Lifesciences LLC, [En ligne].
Adresse URL: http://www.hc-sc.gc.ca/dhp-mps/alt_formats/pdf/prodpharma/sbd-smd/md-
im/sbd_smd_2011_sapien_thv_176966-fra.pdf
[3]. Centre fédéral d’expertise des soins de santé (KCE), (page consultée le 27 février 2012).
L’implantation percutanée de valves aortiques (TAVI): évaluation actualisée de la technologie.
[En ligne]. Adresse URL :
https://kce.fgov.be/sites/default/files/page_documents/kce_163b_tavi_actualisation.pdf.
[4]. Mandegar, M. H. ;Nazeri, I. ;Abdi, S. ;Roshanali, F. 2011(page consultée le 27 février
2012). “ Successful transcatheter aortic valve implantation through ascending aorta and total
revascularization using Edwards SAPIEN Transcatheter Heart Valve System”. Ann Thorac Surg,
Volume.92, N°6, P.2262-3.
<http://www.sciencedirect.com/science/article/pii/S0003497511013312>.
[5]. Rodés-Cabau, J. 2010 “ Progress in transcatheter aortic valve implantation”. (Page
consultée le 27 février 2012). Rev Esp Cardiol, Volume 63, N°4, P 439-50.
http://www.sciencedirect.com/science/article/pii/S0300893210700658
[6]. Recommandations de la Société française de cardiologie concernant la prise en
charge des valvuloplasties acquises et des dysfonctions de prothèse valvulaire. (Page
consultée le 27 février 2012). Arch Mal C?ur Vaisseaux 2005, 98 ; suppl : 5-61
http://www.sfcardio.fr/recommandations/sfc/la-prise-en-charge-des-valvulopathies-
acquises-et-des-dysfonctions-de-prothese-valvulaire/
[7]. ADMINISTRATION, U.S. FOOD AND DRUG. 2012,( page consultée le 27 février
2012). PMA Approvals P 100041, [En ligne]. Adresse URL:
http://www.accessdata.fda.gov/cdrh_docs/pdf10/P100041b.pdf
1
/
4
100%