Cours chimie INTRODUCTION A LA CHIMIE ORGANIQUE 11

Cours chimie
INTRODUCTION A LA CHIMIE ORGANIQUE
11-mai-10
1 STL
I / Qu’est ce que la chimie organique ?
II/ Le carbone : Elément de base de la chimie organique.
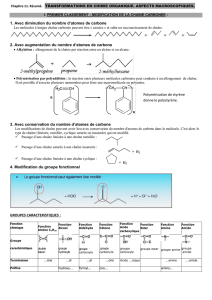
L’atome de carbone
Formule électronique :
- Le carbone à sur sa couche externe.
- Pour saturer sa couche externe à (règle de l’octet), le carbone
peut former 4 doublets liants (ou liaisons covalentes) : Il est
tétravalent. -> Valence : 4
Le carbone peut être lié à quatre, trois ou deux atomes voisins : il établi donc des liaisons qui peuvent être simple,
double ou triple.
Liaisons simples
Liaison double
Liaisons doubles
Liaison triple
Méthane
Méthanal
Dioxyde de carbone
(remarque : cette molécule n’est
pas une molécule organique)
Cyanure d’hydrogène
4 liaisons covalentes
simples
1 liaison covalente double
2 liaisons covalentes
simples
2 liaisons covalentes
doubles
1 liaison covalente triple
1 liaison covalente simple
Carbone tétragonal
(lié à 4 atomes voisins)
Carbone trigonal
(lié à 3 atomes voisins)
Carbone digonal
(lié à 2 atomes voisins)
Carbone digonal
(lié à 2 atomes voisins)
L’atome de carbone peut être lié avec d’autres atomes.
Les autres atomes de la chimie organiques
Les atomes les plus fréquemment rencontrés sont l’hydrogène (H), l’oxygène (O) et l’azote (N).
Atome
H
O
N
Valence
1
2
3
Liaison avec le
carbone
Liaison
simple
méthane
méthanol
méthanamine
Liaison
double
méthanal
méthanimine
Liaison
triple
nitrilométhane
(cyanure
d’hydrogène)
On rencontre également des liaisons avec des non métaux (principalement des halogènes) : Cl, Br , I, S, P…
Et des liaisons avec des métaux : Na, Li, Mg, Zn …
Polarisation des liaisons:
Lorsqu’une liaison covalente unit deux atomes identiques, le doublet est également partagé entre les deux atomes.
Il se trouve à égale distance des deux noyaux.
Si les deux atomes ne sont pas identiques, celui qui est le plus électronégatif1 attire plus fortement le doublet. Le
nuage électronique est déplacé vers l’élément le plus électronégatif : on dit que la liaison est polarisée.
INTRODUCTION A LA CHIMIE ORGANIQUE.docx
Page 1 sur 4
1
L’électronégativité traduit la tendance qu’a un atome d’un élément engagé dans une liaison avec un atome d’un autre
élément, à attirer à lui le (ou les) doublet(s) de liaison.

Exemples :
L’atome de chlore est plus électronégatif. Il
attire le doublet. Il présente donc un excès de
charge négative noté .
L’atome d’hydrogène présente un déficit de
charge négative que l’on note
Si la différence d’électronégativité est trop importante, l’élément le plus électronégatif « accapare » le doublet, ce
qui conduit à la formation d’un ion.
Remarques :
L’électronégativité de l’hydrogène est très proche de celle du carbone de sorte que la liaison C-H est très peu
polarisée.
La polarisation d’une liaison joue un rôle très important dans la réactivité des molécules. ( ce qui explique la faible
réactivité des alcanes composées uniquement de liaisons non polarisées).
III/ Représentation des molécules
Formule brute
Exemples :
(urée) propanol
La formule brute représente peu d’intérêt. On a besoin de connaitre la façon dont les atomes sont liés les uns aux
autres
Formule développée plane
Elle montre l’ordre dans lequel les différents atomes sont liés ensembles.
urée
Propan-1-ol
N C N
O
H
H
H
H
C C C
H
O
H
H
H H
H H
H
Remarque : la formule développée plane ne représente pas la géométrie réelle des molécules : c’est une
représentation plane.
Ces formules sont vites très lourdes à utiliser quand le nombre d’atomes devient conséquent.
Formules semi-développées
Les liaisons avec les atomes d’hydrogène n’apparaissent pas.
urée
Propan-1-ol
Formules topologique
Les liaisons C-C sont représentées par des segments.
Les atomes de carbone ne sont pas indiqués.
Seuls les atomes des groupes caractéristiques sont représentés
urée
Propan-1-ol
INTRODUCTION A LA CHIMIE ORGANIQUE.docx
Page 2 sur 4

IV / Diversités des chaines carbonées
Lorsque les liaisons entre les atomes de carbone sont simples, la chaine est dite saturée.
Lorsqu’il existe des liaisons carbone-carbone doubles ou triple la chaine est dite insaturée.
Si la chaine se referme sur elle-même, la chaine est cyclique.
Lorsqu’un atome de carbone est lié à 3 ou 4 atomes de carbone, la chaine est ramifiée.
Exemples :
Butane
But-1-ène
Cyclohexane
méthylpropane
Chaine saturée
Chaine insaturée
Chaine cyclique
Chaine ramifiée
On peut trouver associé dans une même molécule tous les éléments structuraux définis ici : linéaire, ramifié,
cyclique, saturé, insaturé…
Exemples :
méthylpropène
Vitamine A (rétinol)
Chaine insaturée ramifiée
Chaine insaturée ramifiée + cycle
V / Groupements fonctionnels
Hydrocarbures (Hc) (ce ne sont pas des groupes fonctionnels :
Hc saturés
Alcanes, cyclohexane
C C
Hc insaturés
Alcènes, cycloalcènes
C C
Alcynes, cycloalcynes
C C
Dérivés benzenique
Arènes
Fonctions monovalentes :
Halogénures
C X
Organométalliques
C M
Alcools
C OH
Thiols
C SH
Phénols
OH
Ethers oxydes
C O C
Amines
C N
INTRODUCTION A LA CHIMIE ORGANIQUE.docx
Page 3 sur 4

Fonctions bivalentes
Aldéhydes
C H
O
Cétones
C C
O
Fonctions trivalentes
Acides carboxyliques
C
O
OH
Chlorures d’acide
C
O
Cl
Anhydride d’acide
C O C
OO
Amides
C N
O
Nitriles
C N
Cette notion de fonction permet de classer les quelques 7 millions de composés connus à l’heure actuelle : ils se
répartissent entre un nombre restreint de fonctions importantes.
Il y a un grand contraste entre la réactivité du groupe fonctionnel et la relative inertie chimique de la chaine
carbonée saturée.
INTRODUCTION A LA CHIMIE ORGANIQUE.docx
Page 4 sur 4
1
/
4
100%