docx

Introduction chimie organique Page 1 sur 3
Introduction à la chimie organique
Prérequis : liaisons covalentes, molécules, représentation de Lewis,formule brute, formule semi développée,
formule développée, géométrie des molécules, modèle moléculaire (reproduire les pages 158 et 159)
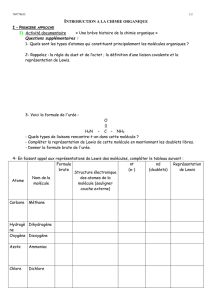
I) DEFINITION
Définition
Exercice
1) Quels sont les éléments présents dans ces molécules
2) Quels sont les éléments communs à toutes ces molécules ?
II) TYPES DE LIAISONS EN CHIMIE ORGANIQUE
1) Règle générale
2) Type de liaisons pour l’élément carbone
a) Nombre de liaisons covalentes
b) Carbone tétragonal
c) Carbone trigonal
d) Carbone digonal
3) Type de liaisons pour l’élément hydrogène
4) Type de liaisons pour l’élément oxygène
5) Type de liaisons pour l’élément halogène

Introduction chimie organique Page 2 sur 3
Tableau récapitulatif
C
H
O
N
X
III) REPRESENTATION DES MOLECULES
1) Formule développée
a) Définition
b) Exemple
Donner la formule développée de l’éthane C2H6
2) Formule semi-développée
a) Définition
b) Exemple
Donner la formule semi-développée de l’éthane
IV) SQUELETTE CARBONE
1) Définition
2) Exemple
Donner le squelette carboné de l’éthane et de l’éthylène C2H4

Introduction chimie organique Page 3 sur 3
V) DIVERSITE DES CHAINES CARBONEES
1) Chaine saturée
a) Définition
b) Exemple
2) Chaine insaturée
a) Définition
b) Exemple
3) Chaine cyclique
a) Définition
b) Exemple
4) Chaine ramifiée
a) Définition
b) Exemple
VI) ISOMERES
1) Définition
2) Exemple
Donnez les isomères correspondant à la formule brute C2H6O
VII) POURCENTAGES MASSIQUES
Donner les pourcentages massiques de carbone, d’hydrogène et d’oxygène dans la molécule d’éthanol de formule
brute C2H6O
Voir aussi page 172
Voir page 180 doc 1 pour ce
paragraphe.
1
/
3
100%