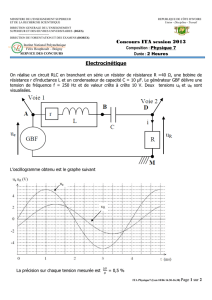
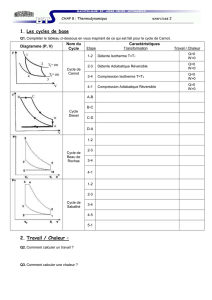
Thermodynamique - mpsi

Lycée François Arago
Perpignan
M.P.S.I.
2012-2013
Thermodynamique
Chapitre 6 : Les machines thermiques
Nous arrivons à ce qui a véritablement motivé la fondation de la thermodynamique : l’étude des machines thermiques
indépendamment de leur technologie. Dans ce chapitre nous allons donc utiliser tout ce que nous avons appris jusque là
avec le premier principe, le second principe et lors de la description du corps pur sous plusieurs phases. Il y aura assez
peu de véritables nouvelles lois dans ce chapitre qui comportera essentiellement de nouvelles définitions et quelques
nouveaux outils.
C’est ainsi que dans la première partie nous allons poser les bases de ce que sont les machines thermiques afin de
voir les différents types de machines qui sont intéressants en pratique. Dans la deuxième partie, nous verrons un des
exemples les plus classiques de machine thermique : le moteur à essence.
Objectifs :
• Savoirs :
–connaître l’écriture particulière des principes de la thermodynamique sur un cycle
–connaître la définition de la performance (efficacité ou rendement) d’une machine ther-
mique
–connaître les signes des transferts thermiques et des travaux reçus par l’agent thermique
dans un moteur, un réfrigérateur et une pompe à chaleur ditherme au coucrs d’un cycle
–connaître l’existence d’une performance maximale (rendement ou efficacité de Carnot)
imposée par le deuxième principe de la thermodynamique pour toute machine thermique
ditherme
• Savoirs faire :
–représenter le schéma de principe d’une machine thermique, en y indiquant les travaux
et les transferts thermiques algébriques mis en jeu
–identifier un cycle moteur ou récepteur d’après le sens de parcours du cycle sur un
graphique
–calculer la performance (efficacité ou rendement) d’une machine thermique
–retrouver l’expression du rendement ou de l’efficacité de Carnot
S. Bénet 1

1 Principe d’une machine thermique
S. Bénet 2/??

4 Étude d’exemples
Les moteurs sont classés selon la technique d’inflammation du mélange air-carburant.
4.1 Moteur à allumage commandé et réalisé par des éclateurs : cycle de Beau de Rochas
Il s’agit du moteur à essence dans lequel un mélange convenable
air-essence, obtenu à l’aide d’un carburateur, est admis dans la
chambre de combustion du cylindre (représenté ci-contre) où l’in-
flammation est produite par une étincelle.
4.1.1 Description et déroulement du cycle à 4 temps
Le cycle (ensemble des phases qui se succèdent dans un cylindre
du moteur) comprend 4 phases ou temps :
•Temps d’admission AB : le mélange {air-carburant} entre dans le cylindre quasiment à la pression atmosphérique,
et le piston se déplace jusqu’à Vmax (point Bappelé Point Mort Bas).
•Temps de compression BC : le piston comprime le mélange jusqu’à Vmin (point Cappelé Point Mort Haut)
•Temps explosion-détente CDE : la bougie provoque une étincelle qui enflamme le mélange {air-carburant}, il
se produit alors une combustion exothermique. Le transfert thermique dégagé lors de cette phase modélise le
transfert thermique reçu par le système de la part de la source chaude.
La pression du mélange Paugmente alors rapidement jusqu’à Pmax (point D) puis il se produit une détente des
gaz jusqu’à Vmax (point E). Lors de la phase, du travail est transmis au système bielle manivelle.
•Temps d’échappement EA :l’expulsion des gaz d’échappement entraîne une diminution de la pression et du
volume jusqu’à Vmin (point A). La soupape d’échappement se ferme, celle d’admission s’ouvre et le cycle recom-
mence.
Admission Compression Explosion Détente Echappement
On voit donc qu’il y a 2 temps moteurs (W < 0) : AB et CDE et 2 temps récepteurs
(W > 0) : BC et EA.
Pour que la machine soit motrice, on associe alors quatre cylindres qui parcourent le
même cycle avec un décalage temporel constant les uns par rapport aux autres.
S. Bénet 3/??

4.1.2 Cycle simplifié : cycle de Beau de Rochas
Le moteur à explosion étant un système ouvert, l’étude va se faire sur le système fermé (Σ) constitué par une masse
mdéterminée de fluide au cours d’un cycle.
Hypothèses :
• Tous les fluides (de l’admission à l’échappement) sont assimilés à un même gaz parfait diatomique (γ= 1,4), et
ce gaz parfait ne subit aucune évolution chimique.
Cette hypothèse est raisonnable car l’air est en large excès dans le mélange et les quantités de N2et O2réagissant
pour donner du NO et du NO2sont négligeable.
• Tout se passe comme si la chaleur dégagée par la combustion était apportée au gaz par une source de chaleur
fictive à la température TC(qui est la température moyenne du gaz parfait après explosion).
• On simplifie le diagramme de Clapeyron qui devient :
–AB :détente isobare sous la pression atmosphérique P0
–BC et DE :transformations adiabatiques réversibles.
Cette hypothèse est légitime car ces étapes sont rapides donc les transferts thermiques à travers les parois
du cylindre et du piston n’ont pas le temps de se faire. De plus, comme nous l’avons déjà vu dans les
applications du premier principe, le temps de relaxation du mélange (i.e. son temps d’homogénéisation) est
négligeable devant le temps de montée du piston, d’où la réversibilité. Enfin, grâce aux lubrifiants employés,
on peut négliger les frottements solides du piston contre la paroi du cylindre).
–CD :échauffement isochore.
La combustion au cours de laquelle le fluide reçoit le transfert thermique (Qchaud >0) est supposée suffi-
samment rapide pour que le piston n’ait pas le temps de bouger.
–EB :refroidissement isochore.
L’ouverture de la soupape d’échappement est instantanée et comme précédemment, le piston n’a pas le
temps de bouger. La pression et la température du fluide diminuent à volume constant : c’est durant cette
phase que le gaz cède un transfert thermique à l’atmosphère (Qfroid >0) qui joue ici le rôle de source froide
àT0.
En remarquant que les travaux échangés au cours des évolutions AB et BA se compensent, on peut oublier ces étapes
au cours desquelles le système (Σ) constitué du gaz contenu dans le cylindre est un système ouvert.
Pour les évolutions BC,CD,DE et EB, en revanche, (Σ) est un système fermé, évoluant au contact de deux sources
de chaleur (la source chaude fictive et l’atmosphère).
S. Bénet 4/??

Dans le modèle adopté, le transfert thermique reçu par le fluide n’est plus issu d’une réaction chimique interne mais
provient d’une source chaude fictive. Il n’est donc plus nécessaire de renouveler le fluide.
Conclusion :
Tout se passe comme si une certaine quantité de gaz constituant un système fermé décrivait indéfiniment le cycle
simplifié BCDE de la figure précédente appelé cycle de Beau de Rochas.
(Σ) échange un travail algébrique Wavec l’extérieur (que l’on peut déjà prévoir négatif étant donné que l’on modélise
un moteur), un transfert thermique algébrique Qchaud avec la source chaude et un transfert thermique algébrique
Qfroid avec la source froide.
On se ramène donc finalement au modèle classique d’une machine cyclique ditherme, mais il faut être conscient des
nombreuses approximations conduisant du moteur à explosion réel au modèle simplifié choisi.
4.1.3 Comparaison du cycle de Beau de Rochas avec le cycle de Carnot
La température de la source chaude correspondrait à la température maximale atteinte au cours du cycle, c’est-à-dire
TD. La température de la source froide serait celle de l’atmosphère, c’est-à-dire T0.
Considérons par exemple les données suivantes :
PB=P0= 1 bar ; TB=T0= 300 K ; taux de compression ou rapport volumétrique a=Vmax
Vmin
= 6
L’efficacité d’un moteur est définie par :
e=
W
Qchaud
=−W
Qchaud
= 1 + Qf roid
Qchaud
Efficacité cycle de Beau de Rochas :
Au cours de la transformation CD (échauffement isochore), on a :
∆C→DU=WC→D+QC→D=⇒nR
γ−1TD−TC=Qchaud
Au cours de la transformation EB (refroidissement isochore), on a
∆E→BU=WE→B+QE→B=⇒nR
γ−1TB−TE=Qfroid
On a donc :
e= 1 +
nR
γ−1TB−TE
nR
γ−1TD−TC= 1 + TB−TE
TD−TC
Or on ne dispose pas des températures TB,TE,TDet TCmais des volumes.
Pour les transformations BC et DE adiabatiques réversibles, on peut appliquer les lois de Laplace. Il vient :
TBVγ−1
max =TCVγ−1
min
TDVγ−1
min =TEVγ−1
max
=⇒
TC=TBVmax
Vmin γ−1
TD=TEVmax
Vmin γ−1
D’où l’efficacité :
e= 1 + TB−TE
Vmax
Vmin γ−1
(TE−TB)
= 1 −1
Vmax
Vmin γ−1= 1 −1
aγ−1A.N. :e= 51,2%
S. Bénet 5/??
 6
6
1
/
6
100%