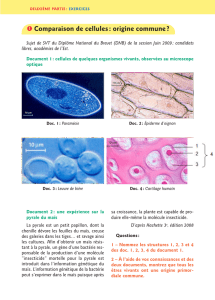
Testage d`hybrides de maïs génétiquement modifiés

Demande d'autorisation pluriannuelle
pour dissémination volontaire de
plantes génétiquement modifiées :
TESTAGE D’HYBRIDES DE MAÏS
GENETIQUEMENT MODIFIES RESISTANTS
A CERTAINS INSECTES LEPIDOPTERES
ET COLEOPTERES ET TOLERANTS A UN
HERBICIDE
PIONEER GENETIQUE SARL

PREAMBULE
Le présent dossier de demande d’autorisation pluriannuelle pour la
dissémination aux champs de plantes de maïs génétiquement modifié est soumis
dans le cadre de la Directive 2001/18/CE.
Les informations contenues dans ce dossier sont liées à l’état d’avancement de la
recherche. La dissémination envisagée concerne des essais de recherche à des
fins réglementaires qui doivent être effectués en Europe selon les principes
directeurs de la Directive 2001/18/CE. L’objectif de ces essais est de collecter des
données sur la composition analytique et l’expression des protéines produites par
les plantes génétiquement modifiées en comparaison avec les plantes
équivalentes non modifiées.
Cette demande est composée d’un dossier technique et d’une évaluation des
risques pour l’environnement.
2

SOMMAIRE
PREAMBULE....................................................................................................................2
SOMMAIRE.......................................................................................................................3
CONTEXTE AGRONOMI
Q
UE
INTRODUCTION..............................................................................................................5
A. LES INSECTES RAVAGEURS DU MAÏS..........................................................5
B. METHODES DE LUTTE CONTRE LES INSECTES RAVAGEURS DU
MAÏS.................................................................................................................................18
C. TOLERANCE A UN HERBICIDE.....................................................................24
CONCLUSION ................................................................................................................25
DOSSIER TECHNI
Q
UE
A. INFORMATIONS GENERALES.......................................................................27
B. INFORMATIONS CONCERNANT L’ORGANISME RECEPTEUR...........27
C. INFORMATIONS CONCERNANT LA MODIFICATION GENETIQUE...31
D. INFORMATION CONCERNANT LA PLANTE SUPERIEURE
GENETIQUEMENT MODIFIEE..................................................................................32
E. CARACTERISATION DU SITE DE DISSEMINATION................................37
F. INFORMATION CONCERNANT LA DISSEMINATION.............................38
G. INFORMATION SUR LES PLANS DE SURVEILLANCE, DE
CONTROLE ET DE TRAITEMENT DU SITE ET DES DECHETS APRES
DISSEMINATION...........................................................................................................39
EVALUATION DES RISQUES POUR L’ENVIRONNEMENT
CONCLUSIONS CONCERNANT LES INCIDENCES POTENTIELLES
SUR L’ENVIRONNEMENT DE LA DISSEMINATION DES PLANTES
SUPERIEURES GENETIQUEMENT MODIFIEES (PSGM)..........................43
3

CONTEXTE AGRONOMIQUE
PIONEER GENETIQUE SARL
4

INTRODUCTION
Cette demande d’essais aux champs porte sur du maïs modifié génétiquement pour
résister à certains insectes Lépidoptères ravageurs, comme la pyrale du maïs et la
sésamie, et à certains insectes Coléoptères ravageurs, comme la chrysomèle des
racines du maïs, et pour tolérer l’application d’herbicides à base de glufosinate-
ammonium. Ce maïs génétiquement modifié est une combinaison d’OGM, obtenue
par le croisement traditionnel de deux lignées parentales de maïs génétiquement
modifiées, l’une étant résistante à certains insectes Lépidoptères et tolérante au
glufosinate d’ammonium, l’autre lignée parentale étant résistante à certains insectes
Coléoptères et tolérante au glufosinate d’ammonium.
La pyrale du maïs, présente sur 70% des surfaces de maïs grain cultivé en France
(figure 12) et la sésamie, localisée principalement dans le bassin Sud de la France
(figure 13), causent chaque année des dégâts économiques importants. Les dégâts
provoqués à l’échelle mondiale par la pyrale du maïs sont estimés à environ un
million d’euros si aucune mesure de contrôle n’est appliquée.
La chrysomèle des racines du maïs est le principal ravageur du maïs en Amérique du
Nord (Etats-Unis, Canada) et cause chaque année des pertes estimées à plusieurs
millions de dollars. En Europe, des dégâts sur les récoltes ont aussi été constatés
depuis 1992. Cet insecte ne cesse de se développer dans les zones où le maïs est
cultivé (figure 8), et il est apparu pour la première fois en France en août 2002. Un
nouveau foyer indépendant a été détecté en juillet 2003 en France. Il faut donc mettre
en place un système de lutte de façon à protéger les cultures de maïs.
A. LES INSECTES RAVAGEURS DU MAÏS
1- La pyrale et la sésamie du maïs : description et cycle biologique, dégâts
causés dans les cultures de maïs et répartition géographique
a)
Description et cycle biologique de la pyrale du maïs (Ostrinia nubilalis)
Le cycle évolutif de la pyrale du maïs, Ostrinia nubilalis, passe par quatre stades :
œuf, larve (chenille), nymphe (chrysalide) et papillon.
C’est à l’état de larve parvenue à son complet développement que la pyrale passe
l’hiver à l’intérieur de sa plante hôte ou de débris végétaux. Au printemps, la larve de
la pyrale se transforme en chrysalide dans son refuge d’hibernation. La nymphe se
présente sous la forme d’un cocon de couleur brune (figure 1). La nymphose dure
environ 3 semaines puis le papillon adulte émerge.
5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
1
/
48
100%