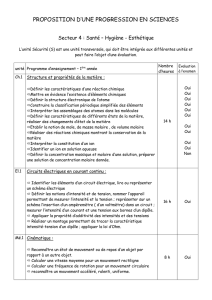
Chapitre 5

1) A l’échelle moléculaire :
I) Loi de conservation de la matière :
Chapitre 5 : REACTION CHIMIQUE ET LOIS DE CONSERVATION
On considère la réaction vive qui a lieu entre le fer (Fe (s)) et le soufre (S (s))
et qui donne le sulfure de fer (FeS (s)) :
La stœchiométrie d'une réaction chimique repose sur deux principes :
- au cours de la réaction, il n'y a ni création ni disparition de matière.
- la nature des atomes reste inchangée. Seuls les échanges d'électrons
sont possibles.
Fe (s) + S (s) → FeS (s)
S 4 F

2) A l’échelle macroscopique :
I) Loi de conservation de la matière :
Partant du principe de conservation de la matière, on en conclut qu'au cours
de la réaction, il y a conservation de la masse :
La masse des réactifs qui réagissent doit être égale à la masse des produits
qui se forment.
On prélève plusieurs exemplaires d’une masse mFe = 5,58 g de fer et d’une
masse mS = 3,22 g de soufre avec une balance électronique.
Les masses mesurées correspondent à un 1/10ème de la masse molaire
atomique de l’élément, indiquée dans le tableau périodique !
Chapitre 5 : REACTION CHIMIQUE ET LOIS DE CONSERVATION S 4 F

2) A l’échelle macroscopique :
I) Loi de conservation de la matière :
A l’aide d’un pilon, dans un mortier, on
mélange une masse 3.mFe ≈ 16,74 g et
une masse 3.mS ≈ 9,66 g :
a) Mélange stœchiométrique :
On dépose le mélange sur une brique
réfractaire et on l'enflamme à l'aide du
bec Bunsen :
Une forte odeur nauséabonde se dégage au cours de la combustion.
Le produit formé est du sulfure de fer (FeS) solide gris et poreux.
La mesure de la masse du sulfure de fer donne mFeS ≈ 26,30 g.
Aux erreurs expérimentales près, la masse de sulfure de fer est égale à la
somme des masses des réactifs de départ.
Chapitre 5 : REACTION CHIMIQUE ET LOIS DE CONSERVATION S 4 F

2) A l’échelle macroscopique :
I) Loi de conservation de la matière :
Dans un mortier, on mélange intimement une masse 3.mFe ≈ 16,74 g et une
masse 5.mS ≈ 16,10 g.
b) Réactif en excès :
On dépose le mélange sur une brique réfractaire et on l'enflamme à l'aide
du bec Bunsen.
En plus de la forte odeur nauséabonde du sulfure de fer (FeS), on sent une
odeur piquante et des fumées blanches, correspondant à un dégagement
d'oxydes de soufre.
La mesure de la masse du sulfure de fer donne mFeS ≈ 26,35 g.
Aux erreurs expérimentales près, la masse de sulfure de fer est égale à celle
de la première expérience.
Chapitre 5 : REACTION CHIMIQUE ET LOIS DE CONSERVATION S 4 F

2) A l’échelle macroscopique :
I) Loi de conservation de la matière :
Pour obtenir une réaction complète, il ne sert à rien de mettre l'un des
réactifs en excès.
c) Conclusion :
Les propriétés physiques et chimiques des réactifs de départ n'ont rien à
voir avec les propriétés physiques et chimiques des produits de la réaction.
Lorsque les réactifs sont pris dans des proportions correctes (mFe et mS, ou
3.mFe et 3.mS, ...) qu'on appelle proportions stœchiométriques, la réaction
peut être totale.
Chapitre 5 : REACTION CHIMIQUE ET LOIS DE CONSERVATION S 4 F
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
1
/
25
100%