Système cardiovasculaire Pr Avierinos 18 pages

SYSTEME CARDIOVASCULAIRE - Insuffisance cardiaque
08/04/2016
GOBBI Amandine L3 (CR : SAIDI Sonia)
Système cardiovasculaire
Pr Avierinos
18 pages
Insuffisance cardiaque (IC) : définition, physiopathologie, diagnostics positifs et étiologiques,
introduction au traitement
A. Généralités
L'insuffisance cardiaque (IC) est une pathologie importante car :
- sa prévalence est élevée et en augmentation : 0,4 à 2% de la population européenne.
- sa prévalence croît avec l’âge : âge moyen au diagnostic = 74 ans.
- pronostic est mauvais si la cause sous-jacente ne peut être corrigée : la moitié des patients vont décéder dans
les 4/5 ans qui suivent le 1er épisode d’insuffisance cardiaque IC (ou avant en cas de forme sévère)
B. Définition
L’IC n’est pas une maladie, c’est un syndrome clinique et radiologique qui traduit l’incapacité du coeur à
assurer un débit cardiaque compatible avec les besoins de l’organisme à un régime de pression normal et à un
moment donné de son fonctionnement.
Elle suppose la présence d’une cardiopathie qui sera longtemps compensée par une série de mécanismes
1/18
Plan :
A. Généralités
B. Définition
C. Mécanismes
D. Etiologie
I. Dysfonction ventriculaire
II. Dysfonction valvulaire
III. Dysfonction péricardique : compression péricardique (tamponnade) ou constriction
E. Physiopathologie
F. Diagnostic du syndrome clinique
I. Identification du syndrome
II. Confirmation de la présence d'une cardiopathie – élimination des diagnostics différentiels
III. Diagnostiquer le mécanisme et l'étiologie
G. Traitement
I. Traitement de l'IC gauche aigue : traitement de l'OAP
II. Traitement de l'IC gauche chronique : traitement de la cardiopathie sous jacente

SYSTEME CARDIOVASCULAIRE - Insuffisance cardiaque
compensateurs: le patient pendant cette phase est asymptomatique et n’est pas en IC.
Puis avec la progression de la cardiopathie et l’épuisement des mécanismes compensateurs apparaissent des
signes en rapport avec l’incapacité du cœur à assurer un débit : ce sont les signes d’aval, tardifs, et des signes
d’amont d’abord, traduisant l’augmentation de pression hydrostatique dans la cavité, siège du
dysfonctionnement et qui se répercute dans les vaisseaux qui s’y drainent: cette traduction clinique de
l’incapacité du cœur, avec signes d’aval et surtout d’amont constitue le syndrome d’IC (avec la présence de
signes cliniques et radiologiques).
La cardiopathie est ce qui cause/ou peut causer l'IC lorsqu'elle est décompensée mais la même cardiopathie
lorsque/ou tant qu'elle est compensée peut très bien ne pas donner d'IC.
C. Mécanismes
A propos du mécanisme et de la cause, le cœur est un système de pompe destiné à remplir deux fonctions:
accueil du sang et éjection du sang. Pour fonctionner ce système nécessite un muscle capable d’éjecter
(fonction systolique) mais aussi de recevoir le sang (fonction diastolique) mais pas seulement; il a aussi besoin
d’un système de valves fonctionnant normalement (absence de fuite et absence de sténose) et d’une enveloppe
souple n’exerçant aucune contrainte sur le muscle en diastole.
Donc ne pas réduire le concept d’insuffisance cardiaque à une seule de ses étiologies qu’est la dysfonction
systolique du VG.
Chaque mécanisme relevant de différentes causes possibles.
D. Etiologie
Les étiologies vont être responsables des différents mécanismes : dysfonction ventriculaire, valvulaire et
péricardique. Ne pas confondre mécanismes et étiologies.
2/18

SYSTEME CARDIOVASCULAIRE - Insuffisance cardiaque
I. Dysfonction ventriculaire
a. Systolique : VG+ et/ou VD
•Origine ischémique : infarctus du myocarde, lésion coronaire ou multi tronculaire pouvant générer une
dysfonction systolique par hypoperfusion du VG.
• Cardiomyopathie dilatée primitive génétiquement déterminée = myopathie du muscle cardiaque qui
donne des dilatations du VG et des diminutions de sa contractilité.
•Cardiopathie dilatée secondaire :
◦à une intoxication éthylique chronique
◦à une chimiothérapie anti-cancéreuse
◦à une hyperthyroïdie
◦suite à une hypocalcémie (carentielle en général),
◦à un dysfonctionnement endocrinologique
◦à une cause virale
• Les dysfonctionnements systoliques du VD sont isolés, très rare. Ils sont d’origine ischémique, liés à
une maladie primitive du VG qui est la dysplasie arythmogène, une exceptionnelle maladie de Uhl, etc.
b. Diastolique : VD++
Dans ce cas là, le VG se contracte normalement mais il y a un trouble de la relaxation, le VG n’arrive plus à
s’expandre pour accepter le retour veineux.
•Cardiomyopathie hypertrophique primitive (CMH), génétiquement déterminée.
•Cardiopathie hypertrophique secondaire à une HTA chronique mal traitée qui a épaissit les parois des
cavités du VG.
•Cardiomyopathie restrictive primitive.
•Cardiomyopathie restrictive secondaire par infiltration des parois VG par une protéine insoluble
l’amyloïde, hémochromatose et pathologie radique la sclérodermie.
Les protéines amyloïdes sont des protéines (le plus souvent des Ig) qui possèdent une mauvaise configuration
spatiale dite béta les rendant insolubles dans les liquides. Elles se déposent ainsi dans différents tissus
notamment le rein, le SNP, le tube digestif et le cœur. On a ainsi une infiltration du tissus myocardique donnant
des cardiomyopathies restrictives avec dysfonction diastolique.
II. Dysfonction valvulaire
•Rhumatisme articulaire aigu (RAA) : première cause de dysfonction valvulaire dans les pays en
développement, ce sont des angines streptococciques mal soignées dans l'enfance qui entraînent une
réaction immunitaire systémique avec des complexes immuns qui se déposent un peu partout dans
l'organisme (dans le cerveau notamment). Au niveau du coeur, ces dépôts vont causer à la longue des
rétractions inflammatoires des structures valvulaires.
•Valvulopathie dégénérative : essentiellement dans les pays occidentaux du fait du vieillissement de la
population.
•Dysfonction valvulaire congénitale.
•Cause infectieuse.
•Cause médicamenteuse
•Cause radique
3/18

SYSTEME CARDIOVASCULAIRE - Insuffisance cardiaque
III. Dysfonction péricardique : compression péricardique (tamponnade) ou constriction
(constriction chronique péricardique)
Infection, traumatique, inflammatoire, radiothérapie, cancer, tuberculose, médicamenteuse, hypothyroïdie…etc.
E. Physiopathologie
L'insuffisance cardiaque est la voie finale commune d'expression de toutes les cardiopathies (valvulaires,
ventriculaires, ou péricardiques).
Sur le plan physiopathologique, si la cardiopathie reste longtemps asymptomatique, c’est qu’elle est
“compensée” par certains mécanismes: particulièrement étudiés dans le cadre de la cardiomyopathies dilatée.
Il faut voir l'IC comme un syndrome neurohormonal qui met en jeu un certain nombre de systèmes
neurohormonaux. ( IC = maladie neurohormonale induite par une cardiopathie ).
Toute cardiopathie quelle qu'elle soit (surtout la dysfonction systolique du VG) met en jeu 2 grands systèmes
compensateurs déclenchés par LA baisse initiale du débit cardiaque (débit = fréquence cardiaque x volume
d'éjection systolique) :
•Le premier d'entre eux est le système orthosympathique par le biais de centre bulbaire dont
l’activation a pour but d’augmenter le débit cardiaque et la contractilité du VG au moyen de
catécholamines. Ce système a 2 effets : inotropisme positif (action tachycardisante) et vasoconstricteur
musculaire et cutané. Cela permet d’augmenter la pression artérielle pour maintenir la perfusion des
organes nobles (cerveau, rein).
•Le deuxième mécanisme mis en jeu est le système rénine-angiotensine-aldostérone (SRAA) par
baisse du débit rénal. L’angiotensinogène est transformée en angiotensine 1 par l’hyper sécrétion de
rénine sous l’effet de la chute du débit rénal. L’angiotensine 1 est transformée en angiotensine 2 par
l’enzyme de conversion laquelle est un puissant vasoconstricteur ce qui augmente la pression artérielle,
maintien de la perfusion des organes nobles. L’angiotensine 2 va aussi stimuler la synthèse
d'aldostérone qui fait réabsorber l'eau et le sel augmentant ainsi la volémie. L'augmentation de volémie
entraîne l'augmentation du remplissage des cavités cardiaques qui donc éjectent mieux : cela participe
au maintien du débit.
4/18

SYSTEME CARDIOVASCULAIRE - Insuffisance cardiaque
Si les conséquences cliniques de l'hypodébit sont tardives (hypodébit cérébral, musculaire, insuffisance
rénale…), les conséquences biologiques de la chute du débit sont précoces et expliquent la bonne tolérance de
la cardiopathie au début de son évolution, qui va être longtemps compensée par des mécanismes neuro-
hormonaux.
Du moment que ces mécanismes compensateurs sont compétents, la cardiopathie sera compensée et le patient
sera alors asymptomatique, il ne sera pas en IC (quelques mois, à quelques années).
Ces mécanismes ont leur limite et s’épuisent à mesure que la cardiopathie avance. En eux même, il aggrave la
cardiopathie car les catécholamines :
–ont un effet pro arythmique sur le VG (l’adrénaline favorise les arythmies).
–entraînent une vasoconstriction artérielle périphérique, qui augmente la post-charge donc les résistances
à l’éjection et cela aggrave l’état du VG déjà affaibli par la cardiopathie.
La grande cause de mortalité des patients avec cardiopathie notamment victime d'une dysfonction systolique du
ventricule gauche est la mort subite rythmique (tachycardie ventriculaire → fibrillation ventriculaire → arrêt
cardiaque par trouble du rythme ventriculaire du à l'hypertonie orthosympathique).
Dans le système SRAA, l’angiotensine 2 est fibrosante et stimule les fibroblastes du VD et VG++ et à terme
elle aggrave toute les cardiopathies par son effet fibrosant (augmentation de la synthèse de collagène).
L'angiotensine 2 est également pro apoptotique et favorise l'apoptose des myocytes. Tous ces mécanismes
aggravent la cardiopathie non seulement de par la présence de l'hypertonie mais aussi par la modification
intrinsèque des différents constituants du cœur.
Il faut interrompre ce cercle vicieux par la thérapeutique, ces mécanismes sont des cibles thérapeutiques.
La base du traitement de fond de la dysfonction systolique du VG : est le blocage des systèmes
neurohormonaux.
Lorsque ces mécanismes sont dépassés, la pression hydrostatique augmente dans la cavité qui dysfonctionne
qui ne se vidange plus, et cette augmentation de pression est transmise aux structures qui se drainent dans cette
cavité, par le jeu des vases communicants.
Les premières manifestation de l'IC seront toujours des manifestations d'amont.
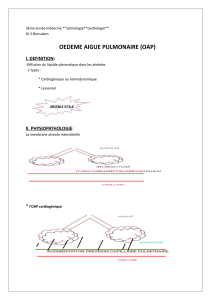
Retentissement d’amont précoce:
✔si la structure qui dysfonctionne est à gauche, les signes d’amont apparaitront dans un premier temps en
amont du coeur gauche au niveau de l’échangeur pulmonaire et définiront l’IC gauche (pas seulement
la dysfonction systolique) : augmentation des pressions dans les veines pulmonaires et dans les
capillaires pulmonaires → si cela dépasse la pression oncotique des protéines → extravasation de sang
dans alvéole pulmonaire → oedème pulmonaire OAP
✔si la structure qui dysfonctionne est à droite les signes d’amont apparaitront en amont du coeur droit au
niveau du réseau veineux systémique et définiront l’IC droite : augmentation de pression dans cavité D
→ augmentation pression dans oreillette D → veines jugulaires se tendent :
- augmentation de la pression dans les veines sus hépatique donc le foie se gonfle
- augmentation de la pression dans les veines porte donc ascite
- augmentation de la pression dans les artères des membres inférieurs donc oedème des membres
inférieurs (plus tardifs et donc relève plus de IC droite chronique alors que l’IC droite aiguë implique
des signes du système veineux haut)
Cette augmentation de pression hydrostatique résulte à la fois de la dysfonction purement mécanique de la
structure qui dysfonctionne et est favorisée par l’activation des systèmes neuro-hormonaux qui stimulent la
réabsorption d’eau et de sel.
5/18
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
1
/
18
100%