8 La fonction amine

Chimie organique mardi 23 mars 2010
1/5
La fonction amine
A - structure – réactivité
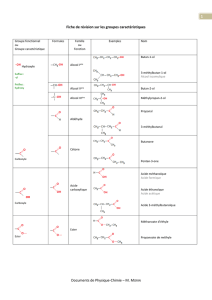
3 classes d’amines
On classe les amines en fonction des propriétés chimiques, communes aux amines puis
les propriétés propres a chaque classe d’amine.
On considère les amines comme des dérivés de substitution de l’ammoniac, NH3, si on
substitue 1 H on a une amine primaire, si on substitue 2H on a une amine II et 3H on a
une amine III.
De par sa structure électronique l’azote possède un doublet non liant sur la 2e couche
donc ce doublet non liant va pouvoir formé une liaison de coordinance premièrement
avec les protons ceci va lui conférer un caractère basique et secondairement avec des
centres pauvres en électrons, ceci lui conférant un caractère nucléophile.
Il existe une différence d’électronégativité relativement importante entre l’azote et
l’hydrogène, cette différence d’électronégativité va entrainé une polarisation de NH d’où
un certain nombre de réactions mettant en jeu cette polarisation et la facilité de départ
de l’hydrogène d’où les 2 types de réactions :
1er action sur certains métaux électropositifs ce sont les
réactions caractéristique des composé a hydrogène mobile
2e action sur les organomagnésiens avec dégagement
gazeux de l’alcane RH.
B – propriétés chimiques communes aux 3 classes d’amines (liées au doublet)
Propriété basique :
Selon Brönsted une base est une entité capable de fixer un proton.
Selon lewis une base fourni un doublet d’électrons
Donc les amines rentrent bien dans ce cadre là.
Une amine capable de déprotoné l’eau selon l’équilibre suivant est caractérisée par une
constante d’équilibre Kb (constante de basicité)

Chimie organique mardi 23 mars 2010
2/5
Si l’on examine la basicité en comparant le pKb, on voit qu’une amine I est plus basique
que NH2, une amine II est plus basique qu’une I et que NH2 c’est facile à expliquer :
Pour les amines I et II l’augmentation de basicité liée à l’augmentation de
substitution est due à l’effet +I de ces substituant qui augmentent la
disponibilité du doublet libre, malheureusement si on regarde une amine
III on voit qu’elle est moins basique que le I et que le II alors qu’on a 3 effet
+I et si l’on s’en tenait à cela on devrait avoir une basicité plus forte. Ceci
est du à l’effet inverse de la solvatation des ammonium obtenus par fixation d’un proton.
A la suite de ces propriétés basiques il y a formation de sels, les sels obtenus sont des
sels d’ammonium quaternaire dans lesquels l’azote est porteur d’une charge positive.
Ces sels peuvent être obtenus par action des acides minéraux selon des réactions totales
alors qu’avec les acides organiques (carboxyliques) on obtient également des
ammoniums mais selon une réaction équilibrée, ce sont les composé ioniques. Pour
nommer ces sels on fait précéder le terme ammonium des groupements alkyles fixés, il
s’agit dans le premier cas d’un diméthyl-ammonium et dans le second cas d’un
monométhyl-ammonium
Propriétés dues au caractère nucléophile de l’azote.
Par suite de l’existence de son doublet libre l’amine I réagie avec l’iodure de méthyle
fortement polarisé du fait de l’électronégativité importante
de l’iode, on obtient donc un iodure d’ammonium
quaternaire cet iodure d’ammonium quaternaire réagit sur
une nouvelle molécule d’amine I pour donné par réaction de
substitution une amine secondaire N – méthylé et un
ammonium quaternaire, par un même mécanisme,
l’amine II obtenue réagit avec une nouvelle molécule
d’iodure de méthyle, le composé obtenu réagit avec une
nouvelle molécule d’amine I pour conduire à une amine III,
cette amine III possède toujours un azote avec un doublet
libre, l’addition d’une nouvelle molécule de CH3-I conduit à
un ammonium quaternaire triméthylé, ce composé réagit
avec un base forte tel que l’hydroxyde d’argent (AgOH) avec
déplacement d’ions iodure par le groupement OH, on
obtient alors un hydroxyde d’ammonium quaternaire qui
est composé instable qui par chauffage va donné une
molécule d’eau, une molécule de triméthyl-amine et un
alcène, l’obtention de cet alcène est anti zeisberg

Chimie organique mardi 23 mars 2010
3/5
Propriétés propres aux amines primaires et secondaires
Nécessite la présence de liaisons NH
1er) Les réactions d’acylation avec les dérivés d’acides
Les dérivés d’acides sont généralement le chlorure d’acide, la réaction conduisant à la
formation d’un amide, il s’agit d’une réaction de substitution d’un H par un groupement
R’-CO.
2e) réaction de sulfonation avec le chlorure de benzènesulfonyle
Cette réaction voit la substitution du chlore par un groupement R-NH et on obtient cette
enchainement R – NH – SO2 qui est un sulfonamide (notamment pour les sulfamides anti
bactériens)
3e) réaction due à la mobilité des hydrogènes
En effet il y a une différence d’électronégativité importante, mais cette électronégativité
est moins marqué que OH car N moins électronégatif que O.
Le sel formé avec libération d’hydrogène est un amidure.
L’action sur les organomagnésiens : il y a formation d’un hydrocarbure, dégagement
gazeux d’un hydrocarbure et formation ensuite d’un composé ionisé
Etant donné la polarisation de la liaison NH, il existe aussi des liaisons Hydrogène, mais
ces liaisons hydrogène sont moins fortes que celles obtenues avec le groupement
hydroxyle, elles permettent d’expliquer les liaisons hydrogènes se formant entre les
bases puriques et pyrimidiques des acides nucléiques
4e) Action de l’acide nitreux
1er l’acide nitreux est un composé instable qui doit être préparé in situ à partir de nitrite
de sodium et d’acide chlorhydrique, cette acide
chlorhydrique outre sa réaction sur le nitrite de
sodium maintiendra un milieu acide avec des
protons H+, l’acide nitreux en présence d’un
proton va perdre une molécule d’eau et formé la
particule réactive qui est électrophile et qui est
l’ion nitrosonium NO+, cette particule
électrophile va s’additionnée sur une molécule d’amine I ou II pour donner un composé

Chimie organique mardi 23 mars 2010
4/5
d’addition qui est un ammonium N+ qui perd spontanément un proton et donner un
composé de couleur jaune caractéristique qui est la
nitrosamine.
Cette nitrosamine est en équilibre tautomère avec sa
forme hydroxylée selon le schéma classique, le
groupement hydroxyle fixe un proton pour donner un
ion oxonium qui perd spontanément un molécule d’eau
et donne un sel de diazonium.
En série aliphatique, ces sels de diazonium sont
instables, ils perdent une molécule d’azote avec formation d’un carbocation qui réagit
avec une molécule d’eau pour donner un alcool et un proton.
Donc le bilan : pour une amine I on obtient un alcool I et un
dégagement d’azote
Pour une amine II on obtient une nitrosamine, la réaction
s’arrête au stade de nitrosamine qui a une coloration jaune
caractéristique.
Pour l’amine III pas de réaction
D – propriétés propres aux amines I
Réaction importante : formation d’imine (base de Schiff), tout simplement, il y a
élimination d’une molécule d’eau avec formation d’une double liaison entre l’azote et le
carbone, le mécanisme de cette réaction :
Il faut un milieu acide pour rentre le carbone de l’aldéhyde plus réactif, si on est
pas en milieu acide on a une simple polarisation, ce carbone dans ce cas là avec H+, on
obtient un carbocation qui est beaucoup plus réactif.
Formation d’un composé d’addition avec un ammonium quaternaire, par tautomérie on
a déplacement d’un atome d’hydrogène sur un atome d’oxygène, déplacement de la
charge + sur l’atome d’oxygène il s’agit donc bien de tautomérie et cette forme
tautomère qui est un oxonium va perdre une molécule d’eau et un proton qui après peut
réagir sur une nouvelle molécule d’aldéhyde et il y a formation d’une imine (C – N)
En effet des protons sont nécessaires pour obtenir le carbocation de la 1er étape, mais
ces protons peuvent également réagir sur l’amine pour formé un ammonium
quaternaire qui ne peux plus réagir sur le carbocation car il n’a plus de doublets libre,
donc il faudra être en milieu
relativement acide mais pas trop pour
ne pas bloqué le doublet libre de
l’atome d’azote

Chimie organique mardi 23 mars 2010
5/5
E – propriétés propres aux amines II
Action sur les dérivés carbonylés,
On obtient un composé d’addition, l’hydrogène de l’amine
secondaire se fixe sur l’oxygène du carbonyle, l’azote sur le
carbone.
On obtient un composé d’addition qui perd une molécule d’eau
pour donner une N amine (N, il y a une double liaison C = C et
en alpha il y a une amine, à ne pas confondre entre les imines
où il y a C = N)
F – propriétés propres aux amines III
L’action sur l’eau oxygéné (peroxyde d’hydrogène), il y formation de N oxyde dans
lequel il y a fonction de coordinance entre l’atome d’azote et d’oxygène, l’oxygène étant
plus électronégatif que l’azote, il accepte le doublet d’électron libre qui lui permet de
saturé sa couche électronique externe.
On part de composé liquide, on obtient des composés solides plus maniables, cette
réaction est utilisé comme réaction intermédiaire pour bloquer le doublet libre de
l’atome d’azote et permet de réaliser des réactions chimiques sur le reste de la molécule.
1
/
5
100%