série 1 - TuniSchool

Exercices - chimie 3ème année Maths Sc.Exp et Sc.Tech
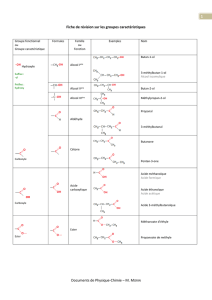
Les amines
On donne : M(H)=1 g.mol-1 ; M(C)=12 g.mol-1 ; M(O)=16 g.mol-1 ; M(N)=14 g.mol-1 ;
M(Cl)=35,5 g.mol-1 ;
Exercice 1
L’analyse d’un échantillon de 2,95 g d’une amine aliphatique a révélée qu’il renferme 0,7 g
d’azote.
1- Déterminer le pourcentage massique de l’azote.
2- Déduire la formule brute de l’amine.
3- Déterminer les formules semi développées, les noms et les classes de toutes les amines
aliphatiques qui correspondent à la formule brute.
Exercice 2
On dissout 7,5 g d'une amine A dans de l'eau pure de façon a obtenir un litre de solution.
On dose un volume V1=40 cm3de cette solution par de l'acide chlorhydrique de concentration C2
=0,2 mol/L.
Le virage de l'indicateur coloré se produit quand on a versé un volume V2= 20,5 cm3 d'acide.
1- Déterminer la masse molaire de l'amine A.
2- Déduire la formule brute de l’amine
3- Quelles sont les formules sémi-développées possibles de A ?
Exercice 3
1- Représenter les schémas de Lewis des atomes d'hydrogène, du carbone et d'azote.
Justifier seulement pour l'atome d'azote.
2- Soit l’amine de formule brute C3H9N. Calculer le pourcentage atomique de chaque atome
dans cette molécule.
3- On fait réagir 0,73 g de l’amine précédente avec un excès d’acide nitreux, on obtient un
alcool.
a- Donner le nom et la formule semi développée de l’amine.
b- Calculer la masse d’alcool obtenu.
c- Déterminer le volume de gaz dégagé.
4- Écrire l’équation de la réaction de l’acide nitreux avec chaque isomère de C4H11N.
Exercice 4 :
Un échantillon de 18 g d’une amine primaire est dissous dans un litre d’eau. On prélève 10 mL
de la solution obtenue que l’on dose par une solution d’acide chlorhydrique de concentration
molaire C1=0,1 mol.L-1 en présence du B.B.T. La solution changede couleur lorsqu’on a versé 40
mL de solution acide.
1- Écrire l’équation de la réaction et préciser les couples acide base mis en jeu.
2- Calculer la concentration molaire de de la solution d’amine.
3- Déterminer la masse molaire de l’amine et déduire sa formule brute et son nom.
4- Calculer la masse du solide que l’on obtient en faisant évaporer la solution obtenue après
changement de couleur.
5- Sur un deuxième prélèvement de la solution d’amine on fait agir une solution d’acide
nitreux.
a- Écrire l’équation de la réaction et donner les noms des composés formés.
b- Comment peut on caractériser les produits de la réaction. Ces derniers confirment ils la
classe de l’amine.
Exercice n°5
On soumet à l’analyse 0,45g d’un composé organique azoté et l’on trouve les résultat suivants :
0,63g de vapeur d’eau ; 0,88g de dioxyde de carbone et 0,14g de diazote.
1) En représentant le composé par la formule CxHyNz, écrire l’équation de sa combustion.
2) Pour déterminer la masse molaire M du composé, on mesure la masse de 1 litre de ce
composé à l’état gazeux et dans les conditions normales de température et de pression, on trouve
une valeur très proche de 2g. En déduire la valeur de M.
3) Déterminer les nombres x, y, z ; puis déduire la formule brute du composé.
4) Sachant qu’il s’agit d’une amine, déterminer les formules semi- développées possibles.
1
/
1
100%