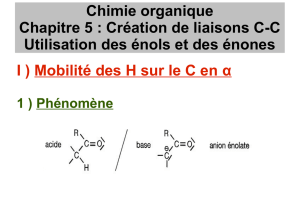
Propriétés chimiques périodiques

Université du Maine - Faculté des Sciences ⌫ Retour CHIM 312 B- complément
Les propriétés périodiques - 2
III - Propriétés chimiques périodiques
Les propriétés chimiques d’un élément dépendent de sa configuration électronique ; elles seront différentes selon que
l’élément appartient à une séquence à 8 (ns, np), 18 (nd, (n+1)s, (n+1)p) ou 32 (nf, (n+1)d, (n+2)s, (n+2)p) éléments.
Ainsi, les lanthanides au degré d’oxydation +III possèdent une configuration électronique 4fn, 5d0, 6s0 ; de ce fait le
rayon des ions diminue régulièrement de La3+ à Lu3+ (1.03 Å à 0.86 Å = contraction lanthanidique) et conduit à des propriétés
chimiques très voisines (basées uniquement sur les électrons f) donc à une séparation difficile des éléments.
De même les propriétés chimiques de Hf, Ta, W et Re (3ième série de transition : configuration = 4f14, 5dn, 6s2) sont très
proches de celles des éléments de la 2ième série Zr, Nb, Mo et Tc (configuration = 4dn, 5s2) car les orbitales profondes 4f
n’interviennent pas.
Un autre exemple est fourni par les éléments Au, Hg, Tl, Pb et Bi dont la configuration électronique est 4f14, 5d10, 6sx et
6py (avec respectivement x = 1, x = 2, x =2 et y =1, x =2 et y =2 puis x =2 et y =3). Les propriétés sont uniquement
dépendantes des couches s et p ; on peut obtenir le degré +I pour Au, Hg et Tl, le degré +II pour Hg et Pb et le degré +III pour
Tl et Bi. De plus, les ions Tl+, Pb2+ et Bi3+ possèdent en commun une paire libre.
1 - Propriétés acido-basiques
Elles sont liées au degré d’oxydation du « métal » et au delà au rayon du cation. Plus les cations sont petits et
chargés, plus ils sont polarisants vis à vis d’un anion et moins ils pourront exister à l’état d’ions libres en solution car
trop acides ; ils forment alors des groupements anioniques dans lesquels la liaison est covalente. Ces groupements
anioniques, de géométrie souvent tétraédrique, sont en général très stables en milieu aqueux. Quelques exemples sont
fournis dans le tableau suivant.
Rayon [4] en Å Cation Groupement anionique Nom
0.11 B3+ BF4- fluoborate
0.26 Si4+ SiO44- silicate
0.17 P5+ PO43- phosphate
0.12 S6+ SO42- sulfate
0.08 Cl7+ ClO4- perchlorate
Parmi les espèces du tableau seul PO43- à un caractère basique marqué ; les autres espèces sont de type neutre à peu
basique (sulfate) en milieu aqueux.
On peut juger du caractère acido-basique d’une espèce en considérant une série d’oxydes. On note que le caractère
acide augmente avec la charge du « cation » (donc dépend du rayon) comme en témoignent les exemples suivants.
Cation : rayon [6] en Å Réaction Caractère
I A Na+ : 1.02 NaOH2OHONa 22 →+ Oxyde basique
II A Mg2+ : 0.78 OH2
2+
+
MgH2MgO →+↓ + Oxyde basique
VA « N5+ » : 0.13
V A « Sb5+ » : 0.60
+− +H2
3
−
6
)OH(Sb
→+ NO2OHON 252
−→++↓ 252 2OH5OH2OSb
Oxyde acide
Oxyde acide
VI A « S6+ » : 0.29 +− +H2
2
4
→+ SOOHSO 23 Oxyde acide
VII A « Cl7+ » : 0.27 +− +H2
4
→+ ClO2OHOCl 272 Oxyde acide
Pour les éléments des familles intermédiaires on trouve un caractère amphotère ; c’est le cas de l’aluminium (III A)
dont l’oxyde (alumine), insoluble en milieu neutre , se dissout facilement en milieu acide ou basique :
OH3 2−→++↓ 232 OH3OH2OAlAl2H6OAl 3
3
2→+↓ ++ +−
4
)OH(Al2 et .
Pour le groupe IV A, on attribue un caractère acide à SiO2 (insoluble dans les acides (sauf HF) et bases) à cause de
la formation facile de sels (fusion des solides) par réaction avec un oxyde basique : Na .
32SiONa→
22 SiOO +
Les oxydes des familles B présentent les mêmes caractéristiques. Pour un même élément, les degrés d’oxydation
inférieurs sont basiques, les degrés intermédiaires amphotères et les degrés supérieurs acides : MO (M = Ti, V, Cr, Mn)
sont basiques ; M2O3 (M = Ti, Cr, V) sont amphotères et TiO2, V2O5, CrO3 ou Mn2O7 sont acides. Seul le zinc (II B)
qui se rencontre uniquement au degré +II possède un caractère amphotère : et
.
OH2
2+
+
−
4
)OH(Zn
ZnH2ZnO →+↓ +
−→++↓ 2OHOH2ZnO

Université du Maine - Faculté des Sciences ⌫ Retour CHIM 312 B- complément
Les propriétés périodiques - 2
2 - Les périodes 1 , 2 et 3
Les 10 premiers éléments du tableau périodique (H→He et Li→Ne) ont des propriétés très différentes des 8 autres
éléments suivants (Na→Ar).
La différence essentielle est une coordinence maximum de 4 pour n = 2 alors qu’on observe une coordinence
pouvant aller jusqu’à 8 pour n > 3. Dans le cas de n = 2, seules des orbitales s et p sont disponibles ; il est alors logique
d’avoir une coordinence maximum de 4 correspondant à une hybridation sp3. Pour n =3 la coordinence supérieure à 4
pourrait s’expliquer par l’utilisation des orbitales vides 3d pour former des orbitales hybrides du type sp3d, sp3d2, sp3d3
ou sp3d4. Les exemples présentés au tableau suivant illustrent cette différence.
Molécule (n = 2) CF4 NF3 OF2 F
2
Coordinence 4 3 2 1
Molécule (n = 3) SiF62- PF6- SF6 IF7 (IF8-)
Coordinence 6 6 6 7 (8)
Parmi ces éléments H et Li se distinguent :
L’hydrogène
C’est un élément singulier puisqu’il ressemble aux alcalins via le degré +I (H+ n’a pas d’existence réelle car trop
petit) et aux halogènes par l’existence de l’ion hydrure H- (ion très gros 2.08 Å). L’hydrogène a tendance à former des
liaisons covalentes dans ses composés (caractère polarisant ou polarisable).
Le lithium
Il se distingue des autres alcalins par sa petite taille (RLi+ = 0.76 Å / RNa+ = 1.02 Å) mais possède le degré
d’oxydation unique +I. Li est moins réactif que les autres alcalins. A cause de sa petite taille il donne des sels hydratés
et des sels souvent moins stables (effet déstabilisant) qu’avec les autres alcalins :
- LiCl
C
→
°
OHO 22 +→
22 COO +
OH,LiClOH2,LiClOH3,LiCl 198
2
C125
2
C15
2→→°°−
C600àchauffage °
- alors que dans les mêmes conditions NaOH reste stable LiLiOH2
C700°
- alors que la même réaction ne se produit qu’au dessus de 800 °C pour Na, K..
32 LiCOLi →
A l’inverse , c’est le seul alcalin à donner un nitrure stable : Li3N. D’autre part, à cause de son électronégativité plus
élevée le composé LiH (plus covalent) est plus stable que ses homologues.
Pour les autres éléments on constate que l’effet de taille entraîne une forte ressemblance des propriétés selon une
diagonale pour n = 2 et n = 3.
3 - Comparaison des propriétés selon une diagonale
La taille des ions est sensiblement constante selon une diagonale si bien que des ions de charges différentes pourront
se remplacer dans une structure. C’est le cas des ions Li+ (0.76 Å) et Mg2+ (0.72 Å) , Na+ (1.02 Å) et Ca2+ (1.00 Å) ; ces
2 derniers ions se substituent dans les micas ((Na, Ca)Al(SiO3)2).
Li et Mg
Ils forment des nitrures de même formulation: 3 et (rappelons que Na, K, …
ne forment pas de nitrures). Les dérivés organolithiens sont utilisés de la même façon que les organomagnésiens en
chimie organique. Néanmoins les liaisons sont plus covalentes avec Mg.
23NLi→2
NMg3 +
2 23NMg→
HCl3
3+HCl4
4+
2→42 SiH→
NLi +
Be et Al
Ces 2 éléments se ressemblent au niveau du pouvoir oxydant : Eo(Be2+/Be) = -1. 85 V et Eo(Al3+/Al) = -1.66 V. Par
ailleurs ils ont le même caractère acido-basique : les hydroxydes sont amphotères (se dissolvent facilement en milieu
basique et acide) et les acidités de Lewis des halogénures sont très voisines. Ils donnent des composés a liaisons
covalentes (si la coordinence est faible pour Al). En dernier lieu les halogénures BeX2 et AlX3 sont très hydrolysables
(X = Cl, Br, I).
B et Si
B est un non métal (donc très différent de Al) ; il se rapproche plus de Si.
Ces éléments forment des halogénures (sauf BF3) qui s’hydrolysent très facilement (car covalents) :
et . )OH(BOHBCl 23 →+ )OH(SiOH4SiCl 24 →+
3"B"2 +On obtient avec l’hydrogène des hydrures très volatils et réactifs : et Si (les
hydrures d’aluminium sont solides et ioniques : M+, AlH4-).
62HB H2+H

Université du Maine - Faculté des Sciences ⌫ Retour CHIM 312 B- complément
Les propriétés périodiques - 2
C et P ; N et S ; O et Cl
Les éléments ne possèdent plus de propriétés métalliques et l’effet de taille ne joue plus de rôle significatif. On
retrouve des électronégativités voisines selon une diagonale. L’élément le plus « lourd » est le moins électronégatif
comme le rappelle le tableau suivant.
Elément C N O F
χ 2.55 3.04 3.44 3.98
Elément Si P S Cl
χ 1.98 2.19 2.58 3.16
Ainsi le chlore ressemble autant à l’oxygène que le soufre ; on obtient facilement des oxychlorures d’éléments de
transition (WO2Cl2).
IV – Evolution des propriétés physiques dans une famille
Un grand nombre de propriétés physiques (points de fusion et d’ébullition, moment dipolaire, dureté, couleur, ..)
pourraient être examinées en fonction de la position occupée par une famille dans le tableau périodique. Nous examinerons
seulement deux d’entre elles : les points de fusion et la couleur.
1 - Points de fusion
Les points de fusion et d’ébullition ne varient pas de manière périodique : des maxima sont observés au milieu des
familles A et B.
a) les éléments ayant la même structure ont un point de fusion qui diminue quand Z augmente : c’est le cas des
alcalins de structure cubique centrée (Tf = 181 °C pour Li et 29 °C pour Cs). On explique cette évolution par une
diminution des forces d’interactions entre atomes liée à l’augmentation du rayon atomique.
b) les halogènes (famille VII A) possèdent des points de fusion bas ; la température évolue de –233 °C pour F2 à +113
°C (sous pression) pour I2. Cette évolution, inverse de la famille I A, est due aux forces d’interactions entre
molécules diatomiques (forces en 1/r6) ; les forces d’interaction (ici de London : entre dipôles temporaires) sont
plus fortes pour I2 car I est plus polarisable que les autres halogènes.
c) les éléments de transition de la famille VI B (Cr, Mo, W) ont une variation inverse avec Z, par rapport aux
alcalins : la température de fusion augmente de Cr (2130 °C) à W (3680 °C). On explique cette évolution pour les
éléments d (sauf I B et II B) par une participation importante des orbitales d à la liaison métal-métal ; le
recouvrement des orbitales étant plus important selon l’ordre 5d-5d > 4d-4d > 3d-3d, il est normal que les métaux
de la série 5d possèdent un point de fusion plus élevé.
d) la température de fusion est liée à la structure de l’élément ; elle augmente lorsqu’on passe d’une structure
moléculaire à une structure tridimensionnelle. Pour la famille V A on observe les résultats suivants :
Famille V A (15) Tf (°C) Structure
N -210 Molécule diatomique
P 44 Molécule tétraédrique
As 814
Sb 631
Bi 271
Solide à couches hexagonales.
Tf diminue quand Z augmente
e) pour une même structure le point de fusion d’un composé est lié à la différence d’électronégativité (∆χ) ; plus ∆χ
augmente plus Tf est élevé.
CF4 SiF4 GeF4
∆χ 1.60 2.36 2.68
Tf (°C) -183 -96 -37
f) pour une même formule et des ∆χ voisins, la température de fusion d’un composé est liée à la structure et au delà à
la coordinence ; Tf augmente avec la coordinence.
∆χ Composé Structure Coordinence Tf (°C)
2.63 BeF2 SiO2 [4/2] 552
2.83 MgF2 Rutile [6/3] 1263
3.01 CaF2 Fluorine [8/4] 1418
3.11 SrF2 Fluorine [8/4] 1477
3.13 BaF2 Fluorine [8/4] 1368

Université du Maine - Faculté des Sciences ⌫ Retour CHIM 312 B- complément
Les propriétés périodiques - 2
Il existe des anomalies à ces prévisions pour les familles I B et II B. En effet, bien que le rayon du cation augmente
avec Z dans une famille, la polarisabilité non négligeable du cation fait qu’on observe facilement des structures de basse
dimensionnalité conduisant à des points de fusion bas ; néanmoins les composés à coordinence la plus élevée ont
toujours Tf le plus haut.
Composé Structure-type Coordinence
du cation Tf (°C)
CuCl ZnS 4 430
AgCl NaCl 6 455
AuCl 1D 2 200 (décomposition)
ZnCl2 HC 4 318
CdCl2 CFC à couches 6 568
HgCl2 Moléculaire 2 280
2 – La couleur des composés
Pour les éléments du bloc s et p ou les ions des familles I B et II B (sous couche d remplie) l’existence d’une couleur
est le résultat d’une transition entre deux états. Tous les composés ioniques MX (ou MXn) sont incolores car la
différence d’énergie entre le niveau HOMO (essentiellement anionique) et le niveau LUMO (essentiellement
cationique) des orbitales moléculaires est très grand ; seules des énergies élevées (issues de longueurs d’onde situées
dans l’UV) seraient capables de provoquer une transition électronique sans pour autant faire apparaître une couleur.
Lorsque la liaison devient plus covalente, la séparation entre niveaux HOMO et LUMO est plus faible (les niveaux
des OA de M et X se rapprochent) et un transfert de charge peut se produire par absorption d’une longueur d’onde
située dans le visible. Les composés présentent alors d’abord une couleur jaune qui peut se déplacer jusque dans le
rouge puis le noir.
La couleur d’un composé donne son aptitude à être réduit par l’opération de transfert de charge :
; cation→
−
2
X2/1+anion e
)1n(
hMMX →−
υ
plus la couleur est foncée plus le composé est instable.
La couleur (par transfert de charge) d’un composé est en fait liée à la différence d’électronégativité mais pas de
manière absolue. Le tableau suivant donne quelques exemples de composés colorés ou non.
Composé AgF AgCl AgBr AgI
∆χ 2.1 1.1 0.9 0.6
Couleur blanc blanc jaune pâle
jaune foncé
Composé HgF2 HgCl2 HgBr2 HgI2
∆χ 2.1 1.1 0.9 0.6
Couleur blanc blanc jaune pâle rouge
Composé PbF2 PbCl2 PbBr2 PbI2
∆χ 2.2 1.2 1.0 0.7
Couleur blanc blanc blanc jaune
Composé ZnO CdO HgO
∆χ 1.9 1.8 1.6
Couleur blanc brun rouge
Composé ZnS CdS HgS
∆χ 0.9 0.8 0.6
Couleur jaunâtre jaune brillant noir
On constate que plus la liaison est covalente plus le composé est coloré (∆χ petit). On peut noter que AgCl, bien que
blanc, noircit par contact prolongé avec la lumière par formation de grains de métal Ag (donc réduction) ; c’est le
principe de la photographie.
1
/
4
100%