CARDIOMYOPATHIE URÉMIQUE

FLAMMARION
MÉDECINE
-
SCIENCES
—
ACTUALITÉS
NÉPHROLOGIQUES
2002
CARDIOMYOPATHIE URÉMIQUE
par
D.C. WHEELER*
Malgré l’efficacité de la dialyse dans la prévention de la mort par urémie, les
patients atteints d’insuffisance rénale chronique ont une espérance de vie très
réduite, ce qui est en grande partie dû au développement d’une atteinte cardio-
vasculaire précoce. Dans l’ensemble, le risque ajusté à l’âge de mortalité cardio-
vasculaire ou d’infarctus myocardique non létal chez les patients en dialyse est de
17 fois supérieur à celui de la population générale [1]. La pathologie cardio-
vasculaire prédominante est une cardiomyopathie urémique, un terme utilisé pour
décrire des modifications structurales et fonctionnelles du cœur qui surviennent en
association avec l’insuffisance rénale chronique (fig. 1). De telles modifications
incluent une augmentation de la masse ventriculaire gauche qui peut être détectée
par l’échocardiographie chez 74 p. 100 des malades débutant un traitement par dia-
lyse [2]. Cette augmentation s’accompagne fréquemment d’anomalies vasculaires
comme par exemple, la rigidité [3], l’artériosclérose et les calcifications artérielles
[4]. L’insuffisance cardiaque congestive qui est une manifestation clinique de la
cardiomyopathie urémique, est présente chez environ un tiers des malades nouvel-
lement dialysés bien que seulement un quart d’entre eux aient une angine de poi-
trine et moins de 10 p. 100 une histoire d’infarctus myocardique [5].
Alors que la diversité des atteintes cardiovasculaires compliquant l’insuffisance
rénale chronique est bien établie à présent, le nombre d’essais cliniques ayant pour
but d’évaluer l’impact de modifications de divers facteurs de risque sur le devenir
cardiovasculaire chez de tels patients est remarquablement limité. Puisque les
patients peuvent déjà avoir des anomalies bien établies des structures cardiaques
au moment où ils débutent le traitement par dialyse, une intervention plus précoce
semble s’imposer [6]. Notre revue a pour but de résumer l’état des connaissances
actuelles de la cardiomyopathie urémique, en insistant tout particulièrement sur
les stratégies thérapeutiques pouvant aider à en réduire la morbidité et la mortalité.
* Center for Nephrology, Royal Free Campus, Royal Free and University College Medical School,
University College London, United-Kingdom.
CARDIOMYOPATHIE URÉMIQUE

238
D
.
C
.
WHEELER
CARACTÉRISTIQUES ÉCHOCARDIOGRAPHIQUES
ET CLINIQUES DE LA CARDIOMYOPATHIE URÉMIQUE
Le diagnostic de la cardiomyopathie est généralement établi par la mesure des
dimensions et de la fonction cardiaque à l’aide de l’échocardiographie. Cet examen
est le plus souvent effectué chez les dialysés ayant atteint leur « poids sec ». De
larges études épidémiologiques réalisées chez les patients sans atteinte rénale évi-
dente ont établi les limites supérieures de la normale pour ces différentes mesures
et les mêmes paramètres ont été adoptés pour définir l’hypertrophie et la dysfonc-
tion cardiaque dans la situation clinique de l’urémie [7]. En cas de cardiomyopathie
urémique, l’épaisseur de la paroi ventriculaire gauche est généralement augmentée
et cette anomalie peut être associée à une augmentation de la cavité ventriculaire.
Une atteinte morphologique sévère peut se manifester aussi bien par une perturba-
tion de la contractilité myocardique, conduisant à une réduction de la fraction
d’éjection (dysfonction systolique), que par une diminution de la compliance ven-
triculaire gauche en diastole, pouvant être détectée par une analyse Doppler du débit
sanguin à travers la valve mitrale (dysfonction diastolique) [8]. En plus de ces modi-
fications des dimensions et fonctions ventriculaires, des investigateurs ont rapporté
une échogénicité myocardique augmentée chez le malade urémique [9]. Cela pour-
rait refléter un degré de fibrose interstitielle et de calcification myocardique plus
élevé dans la cardiomyopathie urémique par rapport à l’atteinte ventriculaire gauche
observée chez les hypertendus non urémiques [9, 10].
La cardiomyopathie urémique peut être cliniquement silencieuse au stade précoce
mais s’accompagner ensuite de dyspnée et de signes d’insuffisance cardiaque
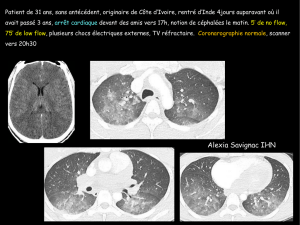
FIG. 1. — Hypertrophie ventriculaire gauche concentrique chez un patient en insuffisance
rénale chronique (étude post-mortem communiquée par le Dr Mary Sheppard).

CARDIOMYOPATHIE
URÉMIQUE
239
congestive. Alors que chez les dialysés, de tels symptômes et signes peuvent résulter
d’une surcharge hydrosodée, une dysfonction cardiaque sous-jacente joue probable-
ment un rôle majeur [11]. Une atteinte anatomique sévère associée à une dysfonc-
tion systolique compromet la réponse cardiaque aux modifications de la pression
de remplissage et prédispose à une hypotension symptomatique au cours de la dia-
lyse [12]. D’autres manifestations cliniques de la cardiomyopathie urémique
incluent l’arythmie qui peut être exacerbée par l’hyperparathyroïdie et par l’isché-
mie ventriculaire et qui est souvent précipitée par des perturbations hydroélectro-
lytiques au cours de la dialyse [12, 13]. Puisque un ventricule gauche sévèrement
atteint peut être incapable de maintenir une pression artérielle élevée, les patients
atteints de cardiomyopathie urémique au stade terminal peuvent développer une
hypotension artérielle. Cela peut expliquer pourquoi des pressions artérielles basses
aussi bien qu’élevées peuvent être trouvées associées à un risque de mortalité accrue
dans les études épidémiologiques effectuées dans des populations de dialysés [14].
L’hypotension au cours de la dialyse, bien que multifactorielle, est susceptible d’être
le reflet d’une atteinte cardiaque sous-jacente. Sa présence a été trouvée associée à
une réserve myocardique réduite en réponse à un stress pharmacologique [15].
PHYSIOPATHOLOGIE
DE LA CARDIOMYOPATHIE URÉMIQUE
Les modifications de la géométrie ventriculaire gauche qui caractérisent la
cardiomyopathie urémique représentent des réponses d’adaptation à une aug-
mentation du travail cardiaque résultant d’une surcharge de volume et de pres-
sion [16]. Chez les patients atteints d’insuffisance rénale chronique, la surcharge
de volume peut résulter de la présence d’une fistule artérioveineuse, d’une réten-
tion hydrosodée et d’une anémie alors que la surcharge pressive peut résulter
d’une hypertension, d’une rigidité artérielle et d’une sténose aortique [17]. La
surcharge de volume augmente la pression ventriculaire gauche au cours du rem-
plissage et étire ainsi la paroi ventriculaire (augmentation du stress diastolique)
[16]. Le cœur s’adapte en allongeant les myocytes existants et en augmentant
ainsi les dimensions internes du ventricule gauche. Cela s’accompagne généra-
lement d’un épaississement de la paroi, une adaptation qui réduit le stress s’exer-
çant sur la paroi. Ainsi la surcharge de volume peut finalement conduire à un
ventricule caractérisé par une paroi épaisse et une cavité plus large, tout en ayant
un rapport normal de l’épaisseur de paroi sur le diamètre interne (hypertrophie
excentrique) (fig. 2). À l’inverse, la surcharge de pression augmente le stress sur
la paroi au cours de la systole, conduisant à une prolifération myocytaire et un
épaississement de paroi avec soit une préservation, soit une réduction du volume
normal de la cavité (hypertrophie concentrique). Ces réponses d’adaptation à la
surcharge de pression et de volume sont essentiellement bénéfiques. Ainsi la
dilatation permet d’augmenter le débit cardiaque à niveau de dépense énergéti-
que comparable, alors que l’épaississement de la paroi redistribue la tension
accrue au niveau de la paroi sur une aire plus large et réduit ainsi la consomma-
tion d’énergie par myocytes [18].

240
D
.
C
.
WHEELER
À plus long terme, ces réponses d’adaptation, qui peuvent être initialement réver-
sibles, peuvent conduire à un déficit énergétique chronique du myocyte et à la mort
cellulaire [19]. Cela s’observe plus facilement en présence d’une atteinte coronarienne
qui est un prédicteur indépendant de la dilatation ventriculaire gauche dans la popu-
lation des urémiques [11]. De telles modifications, résultant d’une mauvaise adapta-
tion à la surcharge de pression et de volume, peuvent également être aggravées par
l’urémie qui peut agir par le biais des toxines urémiques, d’une activité sympathique
excessive et d’anomalies endocriniennes [20]. Par exemple, un déficit en vitamine D
peut contribuer à l’hyperplasie myocardique, alors qu’un excès d’hormone parathy-
roïdienne, d’angiotensine II et d’aldostérone a été incriminé dans la pathogénie de la
fibrose myocardique interstitielle [20-22]. La calcification du myocarde et d’autres
tissus mous peut résulter des perturbations du métabolisme phosphocalcique associées
à l’urémie et peut, comme la fibrose, compromettre les réponses d’adaptation [23].
Finalement, l’urémie elle-même peut contribuer à la microangiopathie cardiaque et
compromettre ainsi l’irrigation sanguine du muscle cardiaque hypertrophié et aggraver
le déséquilibre entre l’approvisionnement et la demande énergétique du myocyte [24].
IMPACT DES ALTÉRATIONS ARTÉRIELLES
SUR L’ATTEINTE MYOCARDIQUE
La surcharge de volume et de pression entraîne des modifications similaires dans
le système artériel ce qui peut aggraver l’atteinte cardiaque. La surcharge de volume
conduit à une augmentation adaptative du diamètre luminal, et la surcharge de
Normal
• Hypertension
Rigidité artérielle
Surcharge de pression
•
Surcharge de volume
• Anémie
• Surcharge hydrosodée
•
Hypertrophie concentrique Hypertrophie excentrique
Fistule AV
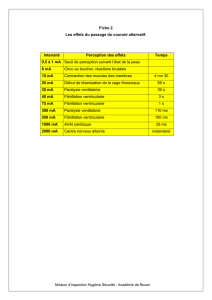
FIG. 2. — Mécanismes et types d’hypertrophie ventriculaire chez les patients en IRC. La
surcharge de pression conduit à une augmentation de l’épaisseur de la paroi ventriculaire
tout en préservant les volumes (hypertrophie concentrique). La surcharge de volume
entraîne une dilatation du ventricule gauche. Celle-ci s’accompagne d’un épaississement
secondaire (grisé) de la paroi qui entraîne une hypertrophie excentrique caractérisée par
un rapport normal entre l’épaisseur de la paroi ventriculaire et le diamètre interne.

CARDIOMYOPATHIE
URÉMIQUE
241
pression conduit à un épaississement de la paroi artérielle [25]. Des réponses ina-
daptées, éventuellement aggravées par l’urémie, comprennent la fibrose et la cal-
cification de la média avec une diminution de la teneur en fibres élastiques pouvant
conduire à une augmentation de la rigidité vasculaire [4, 26]. Ces altérations arté-
rielles qui ressemblent à celles observées au cours de l’artériosclérose liée à l’âge,
conduisent de façon caractéristique à une pression systolique élevée et une pression
diastolique basse (c’est-à-dire une pression de pulsion augmentée) et s’accompa-
gnent d’une augmentation de la vitesse de l’onde du pouls [27]. L’élévation de la
pression systolique augmente le stress de la paroi ventriculaire gauche au cours de
la systole et contribue ainsi à l’hypertrophie concentrique. La rigidité artérielle
entraîne également un retour précoce de l’onde de pression artérielle après sa pro-
pagation à travers l’arbre artériel qui à son tour aggrave la surcharge pressive du
ventricule gauche [28, 29]. De plus, une pression diastolique basse va compromettre
le flux coronaire qui ne peut avoir lieu que lors de la relaxation cardiaque, et pourra
ainsi potentiellement aggraver le déséquilibre entre l’apport et la demande en oxy-
gène du myocyte et ainsi accélérer la mort myocytaire [29]. L’importance poten-
tielle de ces altérations artérielles est soulignée par une étude récente montrant que
la réflection précoce de l’onde artérielle est un facteur de prédiction indépendant
de la mortalité cardiovasculaire et la mortalité globale chez les patients au stade de
l’insuffisance rénale avancée [30].
PRÉVALENCE ET INCIDENCE
DE LA CARDIOMYOPATHIE URÉMIQUE
Plusieurs études d’observations ponctuelles ont étudié la prévalence de la car-
diomyopathie chez des patients atteints à degrés divers d’insuffisance rénale. Elles
ont révélé une hypertrophie ventriculaire gauche chez une plus grande proportion
des malades ayant l’atteinte rénale la plus sévère ; par exemple 16 p. 100, 26 p. 100
et 50 p. 100 des malades ayant une clairance de la créatinine supérieure à 30 ml/min,
de 10 à 30 ml/min et inférieure à 10 ml/min respectivement, avaient une hyper-
trophie ventriculaire gauche à l’examen échocardiographique [31]. Dans une
cohorte personnelle de 369 malades, la proportion de ceux qui avaient une hyper-
trophie ventriculaire gauche à l’examen électrocardiographique allait de 12 p. 100
chez les patients du quintile avec l’atteinte rénale la plus modérée (clairance de la
créatinine médiane de 44 ml/min) à 25 p. 100 dans le quintile avec l’atteinte la plus
sévère (clairance de la créatinine médiane de 11 ml/min) [32]. Un suivi au long
cours de tels patients nous permettra d’évaluer l’incidence de l’hypertrophie ven-
triculaire gauche. Ainsi, par exemple, parmi 191 malades en prédialyse avec une
prévalence de base de 34 p. 100, 10,6 p. 100 d’entre eux ont développé une hyper-
trophie ventriculaire à l’échographie ultérieure après une période de 12 mois et une
augmentation de l’indice de masse ventriculaire gauche (un paramètre dérivé) de
25 p. 100 [33]. Au moment de la mise en dialyse, la majorité d’entre eux aura une
preuve échocardiographique d’hypertrophie ventriculaire gauche et environ un tiers
d’entre eux aura des signes cliniques d’insuffisance cardiaque [2, 34]. À titre
d’exemple, au cours d’une analyse ponctuelle effectuée chez 433 malades cana-
diens débutant leur dialyse, seulement 18 p. 100 d’entre eux présentaient un écho-
cardiogramme normal [11]. Parmi les malades restants, 16 p. 100 présentaient une
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%