CHAPITRE IV : Synthèse énantiosélective des cycles A et B de l

76
CHAPITRE IV :
Synthèse énantiosélective
des cycles A et B
de l'hémibrévétoxine B1

77
CHAPITRE IV : Synthèse énantiosélective des cycles A et B de l'
hémibrévétoxine B1
4.1. Rappels de la littérature
Nous n'avons travaillé jusqu'à présent que sur des composés racémiques. Or dans la
littérature, toutes les synthèses totales sont réalisées à partir des composés énantiomériquement purs.
C'est dans cet objectif que nous avons préparé le composé 6* énantiomériquement enrichi.
O
O
BnO
6*
Plusieurs approches pour obtenir ce composé sont décrites dans la littérature67) parmi
lesquelles nous citons les exemples suivants.
4.1.1. L'utilisation d'un précurseur chiral comme composé de départ
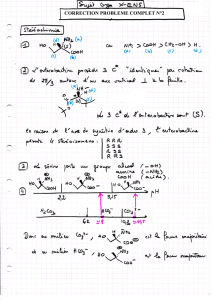
Dans la synthèse totale de la compactine, Kozikowski 68) propose une approche chirale pour la
synthèse de cette énone. Sa synthèse commence par le traitement de l'acroléine par l'éthylèneglycol en
présence d'acide bromhydrique. Le bromoacétal formé réagit ensuite avec le nitrite de sodium pour
donner le composé nitré Ko4. La réaction de ce dernier avec le composé oléfinique Ko5 chiral a été
effectuée dans les conditions de Mukaiyama, à savoir en présence d'isocyanate de phényle et une
quantité catalytique de triéthylamine pour donner les deux isoxazolines diastéréoisomères anti/syn
Ko6 et Ko7 avec un rapport de 4/1 en faveur du diastéréoisomère anti. Après séparation des deux
composés par chromatographie sur gel de silice, le diastéréoisomère majoritaire est transformé en
milieu acide en diol Ko8 avec un rendement quantitatif. Le diol est alors converti en alcool Ko9 après
action du périodate de sodium et du NaBH4.
Après benzylation de l'alcool Ko9 dans les conditions standards, il obtient l'isoxazoline
Ko10 qui est hydrogénée en composé β-hydroxycétone K11 . Finalement, celui-ci est transformé par
l'action du triflate de zinc en énone attendue 6*.

CHAPITRE IV : SYNTHÈSE ÉNANTIOSÉLECTIVE DES CYCLES A ET B DE L'
HÉMIBRÉVÉTOXINE
4.1. Rappels de la littérature
________________________________________________________________________________
78
CHO
O2N
O
OO
O
O
O
ONO
OO
O
ONO
O
HO
OH
ONO
O
ONO
O
OH
1- HBr / HO(CH2)2OH
ON
Ko4PhNCO / Et3N
O
O
84 % Ko6
+
OBn
2- NaNO2
Ko7
4 : 1
O
O
2- NaBH4 60%
1- Na IO4
OBn
H+
OH O
Ko9
1- NaH
2- PhCH2Br
H2 / Raney Ni
CH3OH / H2O / AcOH
O
O
BnO
Ko11
Zn(OTf)2
CH2Cl2
6*
Ko5
Ko8
Ko10
4.1.2. L'utilisation d'un aldéhyde chiral
Il existe de nombreux exemples dans la littérature qui 67,69,70) rapportent la synthèse chirale de
dérivés de l'énone 6* à partir d'un aldéhyde chiral. Nous citerons par exemple les travaux de Reetz
69).

CHAPITRE IV : SYNTHÈSE ÉNANTIOSÉLECTIVE DES CYCLES A ET B DE L'
HÉMIBRÉVÉTOXINE
4.1. Rappels de la littérature
________________________________________________________________________________
79
BnO O
H3C H
OCH3
OTMS
O
O
BnO
CH3
O
O
BnO
CH3
+1- LiClO4
2- AcOH +
> 95 >5
4.1.3. L'utilisation d'un auxiliaire chiral
Des auxiliaires chiraux tels que le menthol et le phénylmenthol fixés sur le diène de
Danishefsky peuvent conduire aux produits de Diels-Alder chiraux 67).
Y
X
R23SiO
O-(-)-menthol
Y
X
R23SiO
O-(-)-Phénylmenthol
4.1.4. L'utilisation de catalyseurs chiraux
Les catalyseurs chiraux 67) sont fréquemment utilisés dans la synthèse de l'énone 6*. Nous
pouvons donner comme exemple le catalyseur chiral issu d'une complexation du (R) ou (S)-binol
avec le Ti(OiPr)4 et utilisé par Keck 71) dans une réaction d'hétéro Diels-Alder dont l'excès
énantiomérique est très satisfaisant.
OCH3
OTMS
O
OBn
HO
O
BnO
+1- 2 mol %
(R,R)-Binol / Ti(Oipr)4
ee = 97%
Rdt = 60%
Nous connaissons également un autre catalyseur chiral de type Cu(II)-bis(oxazoline) utilisé
par Ghosh et ses collaborateurs 72) dans la synthèse totale de la laulimalide. Ghosh a testé l'efficacité
de plusieurs ligands de nature oxazoline. Les meilleurs résultats ont été obtenus en utilisant un ligand
tel que Gh1.

CHAPITRE IV : SYNTHÈSE ÉNANTIOSÉLECTIVE DES CYCLES A ET B DE L'
HÉMIBRÉVÉTOXINE
4.1. Rappels de la littérature
________________________________________________________________________________
80
OCH3
OTMS
O
OBn
HO
O
BnO
+Cat*
5-10 mol %
ee 85%
N
O
Rdt ≤ 60%
N
O
Gh1
Les travaux les plus récents dans ce domaine sont ceux de Jacobsen 18). Il a utilisé pour
réaliser une synthèse asymétrique de cette énone des catalyseurs dont les ligands sont les composés
ci-dessous.
N N
O O
tBu tBu
YY
H H
Cr
BF4-
(R,R) 1 a = Y = tBu
2 a = Y = OMe
Les meilleurs résultats ont été obtenus avec les groupements Y = OMe.
OCH3
OTMS
O
O
HO
O
O
Br Br
+1- Cat*
2- H+
ee = 79%
Rdt = 84%
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
1
/
15
100%