Correction du DS n°8

PC A - PC B CHIMIE - DS n°8 - Correction 1
Partie 1 :
Le mercure
D’après le concours CCP 2010, filière PC (épreuve Chimie 1)
1- Etude de quelques propriétés du mercure
1.1 Atomistique
1.1.1 Configuration électronique de l’atome de mercure, 80Hg, dans son état
fondamental :
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 (ou [54Xe] 6s2 4f14 5d10)
Les électrons de valence sont ceux de la dernière couche en cours de remplissage (ici la
couche n°6), plus, éventuellement, ceux de la dernière sous-couche en cours de
remplissage (ici : aucune car elles sont toutes remplies à 100%).
Donc : 2 électrons de valence, ceux de la sous-couche 6s.
1.1.2 Configuration électronique des cations Hg+ et Hg2+ dans leur état fondamental :
Hg+ : [54Xe] 6s1 4f14 5d10 et Hg2+ : [54Xe] 6s0 4f14 5d10
1.2 Chlorure mercurique, HgCl2
1.2.1 Schéma de Lewis du chlorure mercurique, HgCl2 :
ClHgCl
1.2.2 Géométrie de type AX2 donc linéaire autour de Hg.
1.2.3 HgCl2 est un acide de Lewis (il présente des lacunes électroniques)
Il peut donc donner avec 2 Cl- : HgCl42- ion tétrachloromercurate (II)
Pas de question 1.3 à 1.5
1.6 Solubilité de l’oxyde mercurique HgO dans l’eau
1.6.1 Etablissons le diagramme de prédominance des espèces solubles dans l’eau de
HgO(s) en fonction du pH.
Les espèces solubles dans l’eau de HgO(s) sont : Hg2+(aq), Hg(OH)2(aq) et
2
HHgO (aq)
− (par ordre croissant de basicité).
D’après l’énoncé :
Samedi 22 mai 2010
DS n°8
Chimie des Solutions Aqueuses et Chimie Organique
CORRECTION
Durée : 4 heures

PC A - PC B CHIMIE - DS n°8 - Correction 2
()
22
12
2
HO Hg
KHg OH C
−+
⎡⎤⎡⎤
⎣⎦⎣⎦
=⎡⎤
°
⎣⎦
et
()
32
2
2
H O HHgO
KHg OH C
+
−
⎡
⎤⎡ ⎤
⎣
⎦⎣ ⎦
=⎡⎤
°
⎣⎦
• A la première frontière,
()
2
2
Hg Hg OH
+
⎡
⎤
⎡⎤
=
⎣⎦
⎣
⎦, d’où
2
2
12
3
Ke
KHO
HO
−
+
⎡⎤
==
⎣⎦
⎡⎤
⎣⎦
.
Soit : front1 1
1
p
HpKepK
2
=−
• A la deuxième frontière,
(
)
22
HHgO Hg OH
−
⎡
⎤
⎡⎤
=
⎣⎦
⎣
⎦, d’où 3
2
HO
KC
+
⎡
⎤
⎣
⎦
=°.
Soit : front 2 2
p
HpK=
Diagramme de prédominance :
pH
pKe-1/2pK1pK2
Hg2+ Hg(OH)2HHgO2-
1.6.2 s = [Hg2+] + [Hg(OH)2] + [HHgO2-]
1.6.3 Pour pH < pKe-1/2pK1 : s ≈ [Hg2+]
Et la dissolution de HgO s’écrit : 2
(s) 2
HgO 2H Hg H O
++
+= +
La constante d’équilibre de cette réaction de dissolution est :
2
s1 2
Hg C
K
H
+
+
⎡⎤
°
⎣⎦
=⎡⎤
⎣⎦
s1 2
sC
K
H+
°
⇒=
⎡⎤
⎣⎦ s1
s
log log K 2pH
C
⇒=−
° pente -2
Pour pKe-1/2pK1 < pH < pK2 : s ≈ [Hg(OH)2]
Et la dissolution de HgO s’écrit :
(
)
(s) 2 2
HgO H O Hg OH+=
La constante d’équilibre de cette réaction de dissolution est
()
2
s2
Hg OH
KC
⎡⎤
⎣⎦
=°
s2
s
KC
⇒=
°s2
s
log log K
C
⇒=
° pente nulle
Pour pH > pK2 : s ≈ [HHgO2-]
Et la dissolution de HgO s’écrit : (s) 2 2
HgO H O HHgO H
−
+
+= +
La constante d’équilibre de cette réaction de dissolution est
2
s3 2
HHHgO
KC
+−
⎡⎤⎡ ⎤
⎣⎦⎣ ⎦
=°

PC A - PC B CHIMIE - DS n°8 - Correction 3
s3 2
Hs
KC
+
⎡⎤
⎣⎦
⇒=
° s3
s
log log K pH
C
⇒= +
° pente +1
1.6.4
[
]
[]
[]
4
3
2
2
43
4NHHg
)NH(Hg
⋅
=β +
+
donc à la frontière
[]
44
3
1
NH
β= 43
log 4pNH⇒β=
Diagramme de prédominance en pNH3 :
Hg2+
1/4 logβ4 = 4,85
()
+2
4
3
NHHg
pNH3
1.6.5 Equation-bilan : HgO(s) + 4NH3 + H2O =
(
)
+2
4
3
NHHg + 2 HO-
de constante d’équilibre :
()
[]
2
2
34
4
3
HO Hg NH C
K
NH
+
−
⎡
⎤
⎡⎤
⎡⎤ °
⎣⎦
⎣⎦
⎢
⎥
⎣
⎦
=
2
6,3
4
3
Ke
K10
K
−
β
⇒= =
1.6.6 Augmentation du pH car formation de HO- lors de la dissolution.
1.7 Etude du diagramme E-pH du mercure
1.7.1 Nombres d’oxydation du mercure : Hg2+ (+II) : HgO (+II) ; +2
2
Hg (+I) ; Hg(0)
1.7.2 A : Hg2+ (prédominance) ; B : HgO (existence) ; C : +2
2
Hg (prédominance) et D :
Hg (existence)
(Plus on va vers la droite, plus les espèces sont basiques et plus on va vers les
hauts potentiels, plus les nombres d’oxydation sont élevés.)
Pas de question 1.7.3
1.7.4 On applique la loi de Nernst aux couples redox (A/C et B/C) :
A/C :
[]
[]
0,88V)(
Hg
Hg
030920E 2
2
2
2=+= +
+
log,,
A/B : pH = 1,65 (à montrer à partir de K3)
B/C :
[]
[]
+
+
+= 2
2
4
Hg
H
log03,006,1E , pente –0,12 pH
1.7.5 Dismutation de +2
2
Hg en milieu basique (à partir de pH=3) :

PC A - PC B CHIMIE - DS n°8 - Correction 4
+2
2
Hg + H2O = HgO + Hg + 2H+ ou +2
2
Hg + 2 HO- = HgO + Hg + H2O
1.7.6 La solution contenant des ions du mercure doit être acidifiée pour éviter la
dismutation (ou précipitation) de +2
2
Hg . On doit attendre car les réactions redox sont
parfois lentes.
1.7.7 +2
2
Hg et Hg2+ (car pouvoir oxydant supérieur à celui du cuivre)
+2
2
Hg + Cu = Cu2+ + 2 Hg
Hg2+ + Cu = Cu2+ + Hg
Partie 2 :
Synthèse d’une abestinine
D’après le concours CCP 2010, filière PC (épreuve Chimie 2)
Synthèse du composé 3
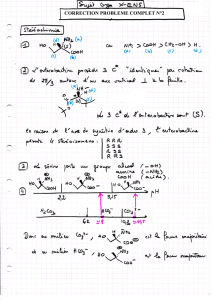
I-1 prop-2-èn-1-ol
I-2 acide hypochloreux : H-O-Cl avec χO > χCl donc no(Cl) = +I
O
HCl AX2E2 coudée à 109 ,5°
I-3 C’est une dismutation.
Milieu acide :
Cl2 + 2e = 2Cl-
2HOCl + 2H+ + 2e = Cl2 + 2H2O
Cl2 + H2O = HOCl + Cl- + H+
Milieu basique :
Cl2 + 2HO- = ClO- + Cl- + H2O
I-4 1° étape : addition électrophile
+HOCl
Cl
OBn
+ HO-
*
OBn
2° étape : substitution nucléophile, attaque en anti, avec passage par le carbocation virtuel le
plus stable :

PC A - PC B CHIMIE - DS n°8 - Correction 5
Cl
OBn
+
OH
Cl OBn
C
*
* HO
I-5 1° étape : réaction acide-base 1
O
Cl OBn +
HO
Cl OBn
+H
2O
**
HO
2° étape : substitution nucléophile intramoléculaire
O
Cl OBn
O
OBn
Cl
+
*
*
L’époxy alcool ne présente pas de stéréochimie unique : on obtient un mélange racémique.
En effet, l’attaque de Cl+ sur la double liaison se fait de façon équiprobable, donc les 2
énantiomères du pont chloronium sont formés en quantité égale. Ensuite, l’ouverture donne un
mélange racémique de C qui conduit à un mélange racémique de l’époxyde D.
I-7 Formation de 5
O
BnO
*
+BrMg
HBrMgO
BnO
*
H
δ+δ+
BrMg-O
BnO
*
H+H+
H-O
BnO
*
H
5
H2O+ Mg2+
+ Br-
Régiosélectivité sous contrôle stérique : ouverture du côté le moins encombré.
I-8 Formation de 6
1° étape : réaction acide-base
O
BnO
*
H
5
+NaH
HO
BnO
*
H
Na+
+ H2
2° étape : substitution nucléophile SN2, synthèse de Williamson :
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%