Miscibilité, solubilité, extraction

Miscibilité, solubilité, extraction
I. Miscibilité de deux liquides : eau / solvant organique
1. Carte d’identité des solvants organiques utilisés : compléter le tableau
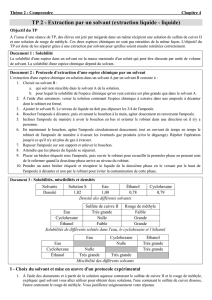
Solvant
Densité
Sécurité (pictogrammes)
Ethanol
0,8
Facilement inflammable
Cyclohexane
0,8
Facilement inflammable
Dichlorométhane
1,3
Nocif par inhalation et
ingestion
2. Expériences, observation, interprétation :
Mélange eau-éthanol :
Il s’agit d’un mélange homogène ; on observe qu’une seule phase ; les deux liquides sont miscibles.
Mélange eau-cyclohexane :
Il s’agit d’un mélange hétérogène ; on distingue deux phases ; les deux liquides ne sont pas miscibles.
La densité du cyclohexane étant inférieure à 1, le cyclohexane est plus léger que l’eau ; l’eau est en
dessous.
Mélange eau-dichlorométhane :
Il s’agit d’un mélange hétérogène ; on distingue deux phases ; les deux liquides ne sont pas miscibles.
La densité du dichlorométhane étant supérieure à 1, le dichlorométhane est plus lourd que l’eau ; l’eau est au-
dessus.
agitation
eau
dichlorométhane
eau
dichlorométhane
agitation
cyclohexane
eau
eau
cyclohexane
agitation
eau+éthanol
eau
éthanol

Les densités des liquides mélangés ne permettent pas de prévoir si les liquides sont miscibles ou non : éthanol
et cyclohexane ont des densités proches ; pourtant l’un est miscible à l’eau, l’autre non.
II. Solubilité d’une espèce chimique dans l’eau et dans un solvant organique
1. Hypothèse :
La solubilité de l’aspirine dans l’éthanol est plus grande que dans l’eau à même température.
D’après les données, on pourrait dissoudre jusqu’à 200g d’aspirine dans 1,0L d’éthanol et seulement 4,2g
dans 1,0L d’eau, à 25°C.
2. Expérience : dissolution du sucre dans deux solvants différents
Le mélange obtenu est
homogène.
Le mélange obtenu est
hétérogène.
3. Conclusion :
L’hypothèse est validée.
L’aspirine est 50 fois plus soluble dans l’éthanol que dans l’eau.
La solubilité est caractéristique d’un soluté dans un solvant donné.
III. Extraction du diiode d’une solution d’eau iodée (bétadine) par un solvant organique :
1. Expérience : Avant agitation Après agitation
2. Interprétation :
- Le diiode présent initialement dans l’eau est « monté » dans le cyclohexane après agitation.
- Ceci est possible, car le diiode est plus soluble dans le cyclohexane que dans l’eau.
Pour réaliser l’extraction d’un soluté, il faut utiliser un solvant qui présente les deux propriétés
suivantes :
- Le soluté à extraire doit y être plus soluble que le solvant dans lequel il est dissous initialement
- Les deux solvants ne doivent pas être miscibles.
Cyclohexane + diiode
Eau
Cyclohexane incolore
Eau + diiode
agitation
Solution hétérogène
eau
aspirine
agitation
Solution homogène
éthanol
aspirine
1
/
2
100%