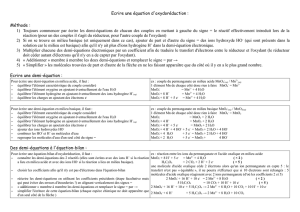
Oxyder les alcools en phase aqueuse

Oxyder les alcools en phase aqueuse
Oxyder les alcools en phase aqueuse
I – Les produits des oxydations ménagées en solution aqueuse
1) Les différentes oxydations
Il existe deux types d’oxydations :
- celles préservant la chaîne carbonée dite ménagée ;
- celles cassant la chaîne carbonée dite totale.
Dans cette rubrique, ne sera traitée que l’oxydation en solution aqueuse.
1) Alcool primaire
Oxydation ménagée en solution aqueuse
Alcool primaire aldéhyde si l’oxydant est en défaut
Alcool primaire acide carboxylique si l’oxydant est en excès
Remarque : l’aldéhyde formé lors de la première étape est facilement oxydable. Pour le conserver
sous cette forme, il faut arriver à l’éliminer du mélange réactionnel avant qu’il réagisse avec l’oxydant.
2) Alcool secondaire
Oxydation ménagée en solution aqueuse
Alcool secondaire cétone
3) Alcool tertiaire
Oxydation ménagée en solution aqueuse
Alcool tertiaire pas d’oxydation
II – Demi-équation des couples organiques en solution aqueuse
1) Comment équilibrer ces demi-équations ?
Ce sont des demi-équations faciles à équilibrer à certaines conditions :
- l’alcool qui est réducteur doit se situer à droite dans son écriture ;
- côté gauche, il suffit de rajouter « 2 H+ + 2 e- » pour R – CHO (aldéhyde) et R – CO – R’
(cétone) ;
- ou « 4 H+ + 4 e- » pour R - COOH (acide carboxylique) et H2O côté droit.
2) Couple aldéhyde / alcool primaire
R - CHO / R – CH2OH R - CHO + 2 H+ + 2 e- = R – CH2OH
3) Couple acide carboxylique / alcool primaire
R - COOH / R – CH2OH R - COOH + 4 H+ + 4 e- = R – CH2OH + H2O
3) Couple cétone / alcool secondaire
R – CO – R’ / R – CHOH – R’ R – CO – R’ + 2 H+ + 2 e- = R – CHOH – R’

II – Équation des oxydations d’alcool en solution aqueuse
1) Quels sont les réactifs ?
Ce sont toujours les ions permanganate (oxydant) et l’alcool primaire ou secondaire (réducteur).
2) Le couple MnO4-(aq) / Mn2+(aq) ?
MnO4-(aq) / Mn2+(aq) MnO4-(aq) + 8 H+ + 5 e - = Mn2+(aq) + 4 H2O(l)
MnO4- est l’oxydant, le sens de la réaction est le suivant :
MnO4-(aq) + 8 H+ + 5 e- → Mn2+(aq) + 4 H2O(l)
3) Comment écrire les équations ?
Les mêmes principes s’appliquent en permanence, il faut :
- mettre la demi-équation de réaction du couple MnO4-(aq) / Mn2+(aq) dans le sens de la formation des
ions manganèse Mn2+(aq) ;
- mettre la demi-équation de réaction du couple contenant l’alcool primaire ou secondaire dans le sens
de la formation de R - CHO, R - COOH, R – CO – R’ ;
- multiplier chaque demi-équation par un coefficient qui permettent d’éliminer les électrons entre les
deux, toujours 5 pour la demi-équation contenant l’alcool et 2 ou 4 pour celle contenant les ions
permanganate ;
- écrire le bilan avec les deux réactifs (en rouge) du côté gauche de l’équation et les deux produits du
côté droit
- terminer par le bilan des molécules d’eau et des ions H+.
4) Oxydation de l’alcool primaire
a - Quels sont les réactifs ?
MnO4- et l’alcool primaire de formule R – CH2OH.
A – Oxydant en défaut
b - Couples en présence et demi-équations de couple
MnO4-(aq) / Mn2+(aq) MnO4-(aq) + 8 H+ + 5 e - = Mn2+(aq) + 4 H2O(l)
R - CHO / R – CH2OH R - CHO + 2 H+ + 2 e- = R – CH2OH
c - Demi-équations de réaction et équation de réaction
MnO4-(aq) + 8 H+ + 5 e- → Mn2+(aq) + 4 H2O(l) x 2
(R – CH2OH → R - CHO + 2 H+ + 2 e-)x 5
_______________________________________________
2 MnO4-(aq) + 6 H+ + 5 R – CH2OH → 5 R - CHO + 2 Mn2+(aq) + 8 H2O(l)
Remarque : Il en est consommé 16 H+ (8 x 2), il se forme 10 H+ (2 x 5), le bilan donne 16 – 10 = 6 H+
consommés.

B – Oxydant en excès
b - Couples en présence et demi-équations de couple
MnO4-(aq) / Mn2+(aq) MnO4-(aq) + 8 H+ + 5 e - = Mn2+(aq) + 4 H2O(l)
R - COOH / R – CH2OH R - COOH + 4 H+ + 4 e- = R – CH2OH + H2O
c - Demi-équations de réaction et équation de réaction
MnO4-(aq) + 8 H+ + 5 e- → Mn2+(aq) + 4 H2O(l) x 4.
(R – CH2OH + H2O → R - COOH + 4 H+ + 4 e-)x 5.
_______________________________________________
4 MnO4-(aq) + 12 H+ + 5 R – CH2OH → 5 R - COOH + 4 Mn2+(aq) + 11 H2O(l)
Remarque : Il en est consommé 32 H+ (8 x 4), il se forme 20 H+ (4 x 5), le bilan donne 32 – 20 = 12 H+
consommés.
Il en est consommé 5 H2O (1 x 5), il se forme 16 H2O (4 x 4) , le bilan donne 16 – 5 = 11 H2O formées.
5) Oxydation ménagée d’un alcool secondaire
a - Quels sont les réactifs ?
MnO4- et l’alcool secondaire de formule R – CHOH – R’.
b - Couples en présence et demi-équations de couple
MnO4-(aq) / Mn2+(aq) MnO4-(aq) + 8 H+ + 5 e - = Mn2+(aq) + 4 H2O(l)
R – CO – R’ / R – CHOH – R’ R – CO – R’ + 2 H+ + 2 e- = R – CHOH – R’
c - Demi-équations de réaction et équation de réaction
MnO4-(aq) + 8 H+ + 5 e- → Mn2+(aq) + 4 H2O(l) x 2
(R – CHOH – R’→ R – CO – R’ + 2 H+ + 2 e-)x 5
_______________________________________________
2 MnO4-(aq) + 6 H+ + 5 R – CHOH – R’→ 5 R – CO – R’ + 2 Mn2+(aq) + 8 H2O(l)
Remarque : Il en est consommé 16 H+ (8 x 2), il se forme 10 H+ (2 x 5), le bilan donne 16 – 10 = 6 H+
consommés.
6) Comparaison d’équations
Les équations des alcools primaires, oxydant en défaut, et des alcools secondaires sont presque
identiques :
2 MnO4-(aq) + 6 H+ + 5 R – CH2OH → 5 R - CHO + 2 Mn2+(aq) + 8 H2O(l)
2 MnO4-(aq) + 6 H+ + 5 R – CHOH – R’→ 5 R – CO – R’ + 2 Mn2+(aq) + 8 H2O(l)
Seules la classe de l’alcool et la nature du composé organique changent.
1
/
3
100%