chap-4-reactions

Chap. 6 Les réactions d’oxydoréduction
A introduire dans ce chap. ou dans chap. 8 sur rédox et vie courante :
La manip ‘le fumigène liquide’ du site ‘la chimie amusante’ cf. lien dans le même répertoire
Oxydation de H2O2 par MnO4- pour donner O2 et Mn2+ (ou plutôt MnO2). De plus cette réaction très
exothermique vaporise de l’eau…
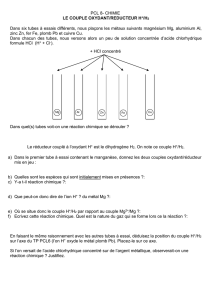
I- Notion d’oxydant, de réducteur, de couple d’oxydoréduction, de demi équation
d’oxydoréduction :
Cf. TP
II- Différentes sortes de couples d’oxydoréduction :
1) Couples cation métallique/métal : forme générale Mn+(aq)/M(s)
Les éléments métalliques de la classification périodique ont tendance à former des ions positifs : des
cations.
Ecrire les demi équations rédox des couples suivants :
Rmq : une demi équation doit être équilibrée…
Couple
Demi équation correspondante
Ag+/Ag
Zn2+/Zn
Al3+/Al
Fe3+/Fe
2) Couples cation métallique/ cation métallique :
Le cation de plus grande charge est alors l’oxydant.
Exemple :
Fe3+/Fe2+ de demi équation : Fe3+ + e- = Fe2+
3) Couples ion monoatomique et molécule :
L’ion est l’oxydant s’il s’agit d’un cation, le réducteur s’il s’agit d’un anion.
Exemples :
H+/H2 2 H+ + 2 e- = H2
I2/I- I2 + 2 e- = 2 I-
4) Couples dans lesquels un élément commun s’associe à l’oxygène :
Couple : MnO4-/Mn2+ ion permanganate/ion manganèse
L’élément commun est donc le manganèse…
La demi équation de ce couple n’est pas facile à trouver : …essayer…
MnO4- + 8 H+ + 5 e- = Mn2+ + 4 H2O
Il faut donc se donner une méthode:

Méthode pour équilibrer la demi équation de ce type de couple :
a) On place les 2 membres du couple :
MnO4- = Mn2+
b) On équilibre la demi équation par rapport à l’élément en commun :
MnO4- = Mn2+ (ici rien à faire de plus)
c) On équilibre la demi équation par rapport à l’élément O : pour cela on utilise des molécules H2O
MnO4- = Mn2+ + 4 H2O
d) On équilibre la demi équation par rapport à l’élément H : pour cela on utilise des ions H+
MnO4- + 8 H+ = Mn2+ + 4 H2O
e) Il reste à équilibrer les charges en utilisant des électrons :
MnO4- + 8 H+ + 5 e- = Mn2+ + 4 H2O
____________________________________________________________________________________
Exercice:
1) Mettre en oeuvre cette méthode pour les couples:
O2 et H2O
S4O62- et S2O32- ion tétrathionate/ion thiosulfate
2) En déduire qu’elle est l’oxydant, quel est le réducteur. Ecrire le couple sous la forme
oxydant/réducteur.
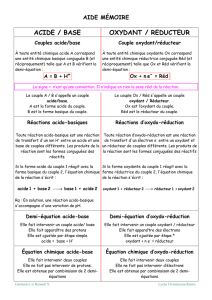
III- Equation d’une réaction d’oxydoréduction :
1) Définition :
Une réaction d’oxydoréduction met en jeu 2 couples rédox.
C’est une réaction chimique entre l’espèce oxydante d’un des 2 couples et l’espèce réductrice de l’autre.
Exemple :
Cu(s) + 2 Ag+(aq) Cu2+(aq) + 2 Ag(s)
2 couples en jeu:
Ag+/Ag et Cu2+/Cu
On a bien:
Ag+ (espèce oxydante de l’un des couples) réagit avec Cu (espèce réductrice de l’autre couple).
Ag+ est un oxydant (il va gagner un électron).
On dit que Ag+, l’oxydant, est réduit au cours de cette réaction pour donner la réducteur conjugué Ag.
Une réduction est donc un gain d’électrons.
Cu est le réducteur (il va perdre deux électrons).
On dit que Cu est oxydé au cours de cette réaction pour donner l’oxydant Cu2+.
Une oxydation est une perte d’électron.
2) Comment trouver l’équation de la réaction d’oxydoréduction à partir des 2 couples mis en jeu ?
Principe :
Au cours d’une réaction rédox, tous les électrons cédés par l’espèce réductrice doivent être acceptés par
l’espèce oxydante.

En conséquence pour obtenir l’équation d’une réaction rédox on combine les 2 demi équations des 2
couples intervenant de façon à éliminer les électrons.
Exemple : soit la réaction entre les ions Fe2+ et les ions MnO4- qui donne des ions Fe3+ et Mn2+
Méthode
Exemple
- On écrit les 2 demi équation l’une en
dessous de l’autre en s’arrangeant
pour mettre les Réactifs de
l’équation rédox à gauche
MnO4- + 8 H+ + 5 e- = Mn2+ + 4 H2O
Fe2+ = Fe3+ + e-
- On multiplie ces 2 demi équations
par un facteur permettant d’avoir le
même nombre d’électron mis en jeu
par les deux demi équation
MnO4- + 8 H+ + 5 e- = Mn2+ + 4 H2O
5 Fe2+ = 5 Fe3+ + 5 e- X 5
- On additionne de part et d’autre du
signe égal et on obtient ainsi, après
avoir simplifier par les électrons,
l’équation rédox !
MnO4- + 8 H+ + 5 e- = Mn2+ + 4 H2O
5 Fe2+ = 5 Fe3+ + 5 e-
MnO4- + 8H+ + 5 e- +5 Fe2+ Mn2+ + 4H2O+5 Fe3++5 e-
L’équation rédox obtenue: MnO4- + 8H+ + 5 Fe2+ Mn2+ + 4H2O+5 Fe3+
IV- Lien avec la classification périodique des éléments :
Il existe un lien entre le caractère oxydant ou réducteur de certaines espèces chimiques et la place
des éléments chimiques dans la classification périodique.
Premier exemple :
L’élément sodium Na, de n° atomique Z=11, a la répartition électronique suivante (cf. seconde) :
(K)2 (L)8 (M)1
Il possède un électron externe et la règle de l’octet nous stipule qu’il va avoir tendance à la perdre:
Na Na+ + e-
Na a donc un caractère réducteur (tendance à perdre des électrons).
Deuxième exemple :
L’élément chlore Cl, de n° atomique Z=17, a la répartition électronique suivante (cf. seconde) :
(K)2 (L)8 (M)7
Il lui manque un électron our avoir une couche externe complète. La règle de l’octet nous stipule qu’il
va avoir tendance à gagner un électron:
Cl + e- Cl-
Cl a donc un caractère oxydant (tendance à gagner des électrons).
De façon générale :
- de nombreux métaux ont un caractère réducteur : Na, Cu, Al, Fe (partie gauche et milieu du
tableau)
- les éléments de la droite du tableau ont plutôt un caractère oxydant. Du coup des espèces
chimiques comme les dihalogènes (F2 , Cl2, Br2, I2) mais aussi le O2 sont des oxydants.
1
/
3
100%