Acides carboxyliques et dérivés

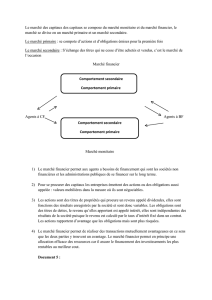
12
1/18
Acides carboxyliques et dérivés
Extrait du programme :
1. Les fonctions « trivalentes »
Pour chaque fonction, il faut connaître :
Groupe fonctionnel, géométrie
Nomenclature
État naturel, propriétés physiologiques
Propriétés physiques (changement d’état, miscibilité)
Propriétés spectroscopiques
1.1. Ester (lactone)
Groupe fonctionnel
Cas particulier : la fonction ester est incluse dans un cycle : c’est alors une
lactone
C
O
O
lié à H ( l'ester est alors un méthanoate ou formiate) ou C d'un groupe alkyle ou aryle
lié à C obligatoirement ( alkyle ou aryle)
OO

12
2/18
Nomenclature :
…oate de …yle.
Première partie du nom dérive du coté « gauche » de l’ester, en comptant le carbone
fonctionnel dans le nombre de C qui permet de nommer ce morceau de molécule.
Deuxième partie c’est le nom du groupe carboné R’ que l’on voit « à droite » dans la
représentation RCOOR’.
Rappel 1 : les fonctions trivalentes sont prioritaires sur les fonctions divalentes aldéhyde et
cétone (qui se nomment « oxo » quand elles sont secondaires) et sur les fonctions
monovalentes : alcool ( hydroxy) amine (amino) halogénoalacane ( halogéno)
Rappel 2 : certains groupes alkyle (notés ) ont des noms traditionnels qu’il est
conseillé de connaître :
isopropyle (iso désigne d’une façon générale un groupe alkyle qui se
termine par une « fourche » à l’opposé de son point d’attache)
tertio = attaché par un C tertiaire
Exemples :
À nommer vous- mêmes :
C
O
H O
méthanoate d'éthyle
ou formiate d'éthyle
C
O
O
butanoate de phényle
C
O
O
HO
4-hydroxybutanoate d'isopropyle
C
O
O
O
*R
*
*tertiobutyle
*
*
phényle benzyle
C
O
O

12
3/18
État naturel :
Assez répandus dans la nature aussi bien chez les animaux que chez les végétaux. Quand ils
sont assez volatils pour parvenir aux sites olfactifs, ils ont souvent une odeur agréable.
Ex : l’acétate d’isopentyle à odeur de banane.
Certaines lactones macrocycliques ont des propriétés pharmacologiques intéressantes
(traitement des parasites intestinaux en médecine vétérinaire)
Il faut citer aussi les triglycérides, triesters du glycérol (propane-1,2,3-triol) et d’un ou
plusieurs acide gras (R est une chaîne carbonée linéaire, saturée ou insaturée d’où
l’appellation saturée ou insaturée de la graisse correspondante). Ce sont des « corps gras »
que l’on trouve dans les huiles, le beurre…
Propriétés physiologiques : peu toxiques, mais ce sont d’excellents solvants qui décapent la
peau et peuvent permettre l’entrée de substances nocives qui n’auraient pas traversé
normalement.
Propriétés physiques :
Températures de changements d’état assez basses, car ils ne comportent pas de liaisons
hydrogène, donc sont seulement attachés par liaisons de van der Waals, assez fragiles.
Toujours à cause de leur mode d’association, ils sont hydrophobes et lipophiles (non
miscibles à l’eau, mais bons solvants des substances organiques)
Propriétés spectroscopiques :
IR :
esters RCOOR’
1750,
diminue qd
la conjug. augmente
C=O élongation
1250
C-O fonctionnel coté R,
élongation
1050
C-O fonctionnel coté R’,
élongation
etc...
RMN : rien de très remarquable, sauf pour les formiates (méthanoates) qui sont analogues
aux aldéhydes par leur « coté gauche » et présentent donc un signal autour de 9 ppm.
OCOR
OCOR
OCOR

12
4/18
1.2. Chlorure d’acyle
Groupe fonctionnel
Nomenclature
Chlorure de …oyle
État naturel
N’existe pas, trop réactif avec l’eau.
Propriétés physiologiques
À titre d’exemple, un extrait d’un document sur le chlorure d’acétyle (éthanoyle). Pour dire
que ce sont des produits peu sympathiques…
Les brûlures en question sont dues à l’hydrolyse du chlorure qui libère de l’acide
chlorhydrique au contact de l’eau.
Les petits, assez volatils, sont lacrymogènes pour la même raison.
Les « plus gros » sont moins inflammables.
C
O
Cl
attaché à un C (alkyle ou aryle)
le chlorure de l'acide formique n'existe pas
C
O
Cl
chlorure de 4-méthylpentanoyle

12
5/18
Propriétés physiques
Peu associés, températures d’ébullition assez basses. La question de leur miscibilité ne se
pose pas souvent, ils réagissent avec beaucoup de fonctions (alcools, amines non tertiaires,
eau…). On les utilise « purs » en les mettant en contact direct avec l’autre réactif.
Propriétés spectroscopiques
Bande C=O en IR, mais là encore on n’a que rarement besoin d’aller jusqu’aux spectroscopies
pour les reconnaître.
1.3. Anhydride d’acide
Groupe fonctionnel
L’anhydride peut être symétrique (c’est souvent le cas) ou mixte avec deux groupes
différents.
Il peut être cyclique
Nomenclature
Anhydride …oïque pour les symétriques. Il est peu probable que vous ayez à nommer un
mixte.
État naturel
N’existe pas (très réactif avec l’eau)
Propriétés physiologiques
Pour l’anhydride acétique. Moins désagréable que le chlorure, mais à peine…
C
O
OC
O
liés à des C d'alkyle ou aryle
l'anhydride de l'acide formique n'existe pas
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
1
/
18
100%