saponification

Changement de réactif Page 1 sur 3
Contrôle de l'évolution d'un système chimique par
changement d'un réactif (saponification)
Introduction
La réaction d'estérification étudiée au chapitre précédent est limitée par l'hydrolyse de l'ester formé. L'idée est de
remplacer l'acide carboxylique par un anhydride d'acide de façon à ne pas obtenir d'eau en même temps que l'ester
pour que l'hydrolyse de cet ester ne puisse pas avoir lieu.
De la même façon, l'hydrolyse d'un ester réalisée avec de l'eau, produit un alcool et un acide carboxylique. L'idée est
de remplacer l'eau par un autre réactif (HO-) pour ne pas obtenir un acide carboxylique mais sa base conjuguée (l'ion
carboxylate) qui ne réagit pas avec l'alcool formé.
Finalement le changement d’un réactif permettra d’obtenir des réactions totales.
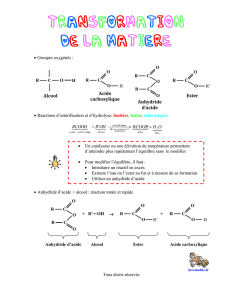
I) ANHYDRIDES D’ACIDES
1) Groupe caractéristique
Le groupe est constitué de 2 atomes de carbone liés à 3 atomes d’oxygène :
2) Formule générale d’un anhydride
R : représente un groupe alkyle
3) Préparation d’un anhydride d’acide
Principe : Un anhydride d’acide résulte de l’élimination d’une molécule d’eau entre deux molécules d’acides carboxyliques.
Exemple : écrire l’équation générale de la formation d’un anhydride
4) Nomenclature
Le nom d’un anhydride d’acide s’obtient en remplaçant le mot acide par anhydride de l’acide carboxylique correspondant.
Exemple :
1) Ecrire en formule semi-développée la réaction :
2 acide propanoïque donnent anhydride propénoïque
2) Donner la formule de l’anhydride éthanoïque, puis écrire l’équation de sa préparation.
II) SYNTHESE D’UN ESTER A PARTIR D’UN ANHYDRIDE D’ACIDE
1) Equation de la réaction
La réaction d’un anhydride d’acide avec un alcool conduit à la formation d’un ester et de l’acide carboxylique correspondant à
l’anhydride d’acide..
Anhydride d’acide + alcool = acide + ester
Ecrire l’équation générale en formules semi-développées.
Exemple : on fait réagir le butan-1-ol et l’anhydride éthanoïque .Ecrire en formule semi-développée l’équation de la réaction.
2) Caractéristiques de la réaction
a) Réaction totale ou quantitative
Pourquoi cette réaction est-elle totale ?
Conclusion
b) Cinétique de la réaction
On retiendra : si on remplace l’acide carboxylique par un anhydride d’acide la réaction d’estérification devient rapide et
totale ou quantitative.

Changement de réactif Page 2 sur 3
3) Technique expérimentale
On utilisera le chauffage à reflux : justifier ce choix.
Voir cour précédent et page 350.
III) HYDROLYSE BASIQUE DES ESTERS : LA SAPONIFICATION
1) Equation de la réaction
La réaction d’un ester avec les anions HO– conduit à un alcool et à un anion carboxylate (base conjuguée de l’acide
carboxylique correspondant)
Cette réaction chimique est appelée saponification ou hydrolyse des esters en milieu basique.
Ester + OH- = ion carboxylate + alcool
Ecrire l’équation générale de saponification en formule semi- développée.
Exemple : on réalise la saponification de l’éthanoate de butyle écrire l’équation en formule semi-développée
Caractéristiques de l’équation de saponification
a) Réaction totale ou quantitative
Pourquoi cette réaction est-elle totale ?
Conclusion
b) Cinétique de la réaction
IV) LES SAVONS :
1) Les corps gras
a) Le glycérol
Le glycérol est appelé propan-1,2,3-ol : donner la formule semi-développée, préciser la classe des alcools. Le glycérol
b) Acides gras
Exemple : l’acide oléique à pour formule C17H33 COOH. L’écriture topologique ci-dessous en donne la description :
Quelle est sa particularité ?
c) Corps gras ou triglycérides ou lipides
Exercice : L’oléine est le corps gras prépondérant dans l’huile d’olive. C’est un triglycéride provenant de la réaction
d’estérification des trois groupes caractéristiques alcool du glycérol par l’acide oléique. Ecrire l’équation de formation de l’oléine.
2) Saponification des corps gras
La saponification d’un triester d’acides gras est l’hydrolyse basique (soude ou potasse) des trois fonctions ester du glycéride.
Elle conduit au glycérol et à un mélange de carboxylates de sodium ou de potassium selon la base utilisée.
Equation : ici c’est l’hydroxyde de sodium qui a été utilisé.

Changement de réactif Page 3 sur 3
3) Nature des savons
V) PROPRIETES DES SAVONS
1) Solution dans l’eau
2) Propriété de l’anion carboxylate
3) Pouvoir détergent des savons
4) Pouvoir moussant
5) Limites d’utilisation des savons
Exercise : synthèse de l’aspirine
Quels sont les groupes caractéristiques présents dans l’acide salicylique
Compléter l’équation ci-dessous et identifier l’aspirine.
Fabrication industrielle du savon : http://www.marius-fabre.fr/site_r01entreprise/0100.htm
1
/
3
100%