CINETIQUE CHIMIQUE

CINETIQUE CHIMIQUE
I ) Définitions - Généralités
La cinétique chimique est l’étude du déroulement des réactions chimiques.
C’est l’étude des vitesses de réaction.
Les réactions chimiques thermodynamiquement possibles (énergétiquement possibles)
peuvent classées selon la vitesse à laquelle elles évoluent (on parle alors de critères
cinétiques).
•
••
• Les réactions rapides
Ces réactions sont quasi-instantanées et évoluent trop rapidement pour être étudiées de
manière cinétique.
Ce sont : - les réactions acides-bases.
- les réactions de précipitation
- les réactions de combustion
- les réactions explosives
•
••
• Les réactions lentes
Ces réactions sont obtenues au bout de quelques minutes voire quelques heures. Ce sont
ces réactions qui sont étudiées.
Exemples : - certaines réactions d’oxydoréduction
- les réactions d’estérification
•
••
• Les réactions très lentes
Ces réactions évoluent en quelques jours, quelques mois ou quelques années.
Exemples : - formation de la rouille
- décomposition de l’eau oxygénée.
II) Vitesse de réaction
1) Vitesse d’apparition
Lorsqu’une réaction produit un composé A, la concentration en ce composé augmente avec
le temps.
a) Vitesse moyenne d’apparition
La vitesse moyenne d’apparition entre les dates t1 (concentration C1) et t2 (concentration C2)
est donnée par :
vt
moyenne = C - C
- t = C
t
21
12
∆
∆∆
∆
∆
∆∆
∆
b) Vitesse instantanée d’apparition
La vitesse instantanée d’apparition d’un composé est égale à la dérivée de la concentration
en ce composé par rapport au temps.
v = d C
d t

2) Vitesse de disparition
Lorsqu’un composé disparaît au cours d’une réaction, sa concentration diminue avec le
temps.
a) Vitesse moyenne de disparition
Entre les dates t2 et t1 la vitesse moyenne de disparition est :
vt
moyenne = - C - C
- t = - C
t
21
12
∆
∆∆
∆
∆
∆∆
∆
b) Vitesse instantanée de disparition
La vitesse instantanée de disparition d’un composé est : v = - d C
d t
3) Unités
Les vitesses de réaction s’expriment en mol L - 1 s - 1 ou mol L - 1 min - 1.
Dans certains cas, on mesure des vitesses de réaction en mol s- 1 ou en mol min - 1, on a
alors v = d n
d t (n étant le nombre de moles du composé étudié à l’instant t)
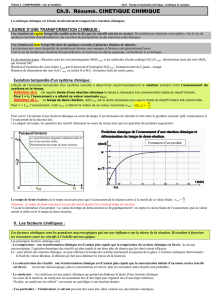
4) Détermination pratique des vitesses de réaction
Pour déterminer pratiquement la vitesse de réaction, on trace la courbe donnant la
concentration du composé étudié en fonction du temps.
a) Vitesse moyenne.
La vitesse moyenne entre les dates t2 et t1
est donnée par :
vt
moyenne = C - C
- t = C
t
21
12
∆
∆∆
∆
∆
∆∆
∆
La vitesse moyenne représente donc la
valeur absolue de la pente de la corde (AB).

b) Vitesse instantanée
La vitesse instantanée à la date t est :
v = d C
d t
La vitesse instantanée représente la valeur
absolue de la pente de la tangente à la courbe en
A.
III) Temps de demi réaction
Le temps de demi réaction τ
ττ
τ12 est la durée nécessaire pour consommer la moitié des
réactifs initiaux en défaut.
Remarque : la réaction n’est pas terminée à la date t = 2τ
ττ
τ12
IV) Facteurs cinétiques
On appelle facteurs cinétiques les paramètres qui influent sur la vitesse de réaction.
1) Concentration
En solution, les vitesses de disparition des réactifs et de formation des produits d’une
réaction décroissent lorsque les concentrations en réactifs diminuent.
En effet, plus la solution est concentrée, plus la probabilité de rencontre entre les réactifs est
importante, donc plus la vitesse de réaction est importante.
2) Cas de réactions avec un réactif solide
La réaction est d’autant plus rapide que la surface de contact entre les réactifs est
importante. Ainsi l’utilisation d’un réactif en poudre permet d’accélérer la réaction.
On dit que la surface de contact est un facteur cinétique.
3) Température
D’une manière générale, la vitesse de réaction croît avec la température. En effet, lorsque la
température augmente, l’agitation moléculaire augmente et la probabilité de rencontre des
réactifs augmente.
Application : La trempe
La trempe désigne le refroidissement brutal que l’on applique à un mélange réactionnel pour
stopper l’évolution de la réaction.

4) Autres facteurs cinétiques
D’autres facteurs cinétiques peuvent influer sur certaines réactions, comme par exemple :
- l’éclairement
- la nature du solvant
- la pression dans le cas de réactions entre gaz.
V) Catalyse
1) Définition - Généralités
Un catalyseur est une substance qui augmente la vitesse de réaction sans intervenir dans
l’équation-bilan.
En aucun cas, un catalyseur ne peut rendre possible une réaction thermodynamiquement
impossible.
Dans le cas de réactions équilibrées, le catalyseur ne modifie pas l’état d’équilibre.
Le catalyseur se retrouve intact à la fin de la réaction.
De nombreux catalyseurs ne peuvent accélérer qu’une réaction donnée, on dit qu’ils sont
spécifiques à cette réaction.
2) Catalyse homogène
La catalyse est homogène lorsque les réactifs, les produits et le catalyseur forment une
seule phase gazeuse ou liquide.
Lorsqu’une espèce chimique intervient comme catalyseur d’une réaction chimique, on
observe les caractéristiques suivantes :
- La réaction globale se décompose en deux ou plusieurs étapes, il y a modification en
présence du catalyseur du mécanisme réactionnel.
- Au moins une des étapes consomme le catalyseur et au moins une le régénère.
- Des intermédiaires réactionnels peuvent intervenir au cours des étapes du mécanisme
sans apparaître dans le bilan final de la réaction.
Dans la catalyse homogène, la réaction est d’autant plus rapide que la concentration en
catalyseur est importante.
3) Catalyse hétérogène
La catalyse est dite hétérogène lorsque le catalyseur appartient à une phase différente de
celle des réactifs.
Lors d’une catalyse hétérogène la réaction se déroule en plusieurs étapes :
- La diffusion des réactifs vers la surface du catalyseur.
- L’adsorption des réactifs à la surface du catalyseur. Il se crée alors une véritable
liaison chimique entre la surface du catalyseur et les molécules du réactif (chimisorption).
Ceci modifie la réactivité, en diminuant les énergies de liaison. Les sites d’adsorption sont
appelés sites actifs.
- Réaction entre les réactifs.
- Désorption des produits formés. Les molécules des produits de la réaction se
détachent de la surface du catalyseur.
En catalyse hétérogène, la réaction est d’autant plus rapide que la surface du
catalyseur est grande.

4) Catalyse enzymatique
En biologie, certaines réactions sont catalysées par des substances produites par les
cellules : les enzymes.
Les enzymes sont des enchaînement d’acides aminés.
5) Autocatalyse
Certaines réactions chimiques produisent leur propre catalyseur, elles sont autocatalysées.
Un des produits de la réaction est alors le catalyseur.
Dans ce cas, la réaction s’accélère en cours de réaction, puis ralentit par épuisement des
réactifs.
L’allure de la courbe donnant la concentration d’un produit formé en fonction du temps est
alors la suivante :
1
/
5
100%