1re année chapitre 2

Chapitre 2 - 1
Chapitre 2
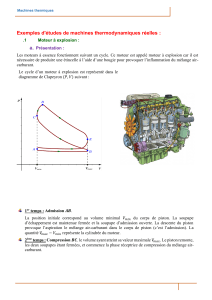
Le cycle théorique Beau de Rochas
1 Les quatre opérations d’un moteur thermique
Une opération est l’ensemble des processus physico-chimiques représentant une étape dans le
fonctionnement du moteur.
Les quatre opérations d’un moteur à piston sont :
1 - Admission du mélange gazeux.
La descente du piston provoque une dépression et par conséquent une aspiration des gaz.
2 - Compression de la charge admise.
Le gaz admis dans un premier temps est comprimé.
3 - Combustion + détente des gaz brûlés.
Au moment où le piston arrive au PMH, une étincelle jaillit qui provoque la combustion du mélange
gazeux. La combustion est presque instantanée. La pression des gaz chasse le piston vers le bas.
4 - Echappement des gaz brûlés.
Le piston remonte en évacuant les gaz brûlés vers l'extérieur.
soupape d'admission soupape de refoulement Mouvement du piston
1
2
3
4
ouverte
fermée
fermée
fermée
fermée
fermée
fermée
ouverte
PMH ð PMB
PMB ð PMH
PMH ð PMB
PMB ð PMH
On définit un temps du moteur comme une course de piston ou 180 ° vilebrequin.
Les quatre opérations se déroulent les unes à la suite des autres ou dans d'autres circonstances, les
unes en même temps que d'autres.
Dans le premier cas, un temps du moteur est égal à une opération. Il s'agit alors d'un moteur 4
temps. Dans le deuxième cas, les opérations se chevauchant, le temps est différent de l'opération, il
s'agit d'un moteur 2 temps.

Chapitre 2 - 2
2 Le cycle Beau de Rochas
Le cycle est la suite de phénomènes qui se reproduisent dans un ordre déterminé avec retour
aux conditions initiales.
2.1 Hypothèses du cycle Beau de Rochas1
q l'ouverture et la fermeture des soupapes sont instantanées.
q les pressions s'égalisent instantanément.
q la combustion est instantanée.
q il n'y a pas d'échange de chaleur avec les parois.
2.2 Lois thermodynamiques
2.2.1 Paramètres définissant l'état d'un gaz
- p : pression ( Pa ou bar)
- T : température (K)
- V : volume (m³, dm³ ou cm³)
- m : masse ( kg )
2.2.2 Lois et diagramme indicateur
Le cycle des moteurs est en général représenté sur un diagramme indicateur. Il s’agit d’un
diagramme présentant en ordonnée la pression et en abscisse le volume (= diagramme (p,v)).
Loi des gaz parfaits
La loi des gaz parfaits s’exprime comme :
moles de nombre n et
parfaits gaz des constante R avec
nRTpv
==
=
=8.31 J/mole.K
Si le nombre de moles n est constant, on peut écrire :
1 Pour plus d’informations, voir cours de thermodynamique
constante=
⋅
T
Vp

Chapitre 2 - 3
Loi de Gay-Lussac - transformation isobare
pconstante
v
T
constante=⇔=
Une transformation est dite isobare quand
elle s'effectue à pression constante.
Loi de Charles - transformation isochore
vconstante
p
T
constante=⇔=
Une transformation est dite isochore quand
elle s'effectue à volume constant.
Loi de Boyle - Mariotte - transformation isotherme
T
constante
pv
constante
=
⇔
=
Une transformation est dite isotherme quand
elle s'effectue à température constante.
Transformation adiabatique
pv constante
pv
T
constante
γ
=
=
Une transformation est dite adiabatique quand elle s'effectue sans échange de chaleur avec
l'extérieur.
Remarque : le γ est une grandeur thermodynamique qui est constante pour les gaz parfaits et vaut
1.414.

Chapitre 2 - 4
2.3 Description du cycle
2.3.1 L'admission ( AB )
Le volume augmente et la pression dans le cylindre tend à diminuer. L'air extérieur vient combler
le volume inoccupé. Comme l'on considère que les pressions s'égalisent instantanément, la pression
dans le cylindre reste égale à la pression atmosphérique.
2.3.2 La compression ( BC )
Le volume diminue et les soupapes sont fermées. La pression et la température vont donc
augmenter. Les gaz sont comprimés. La transformation est adiabatique : il n'y a pas d'échange de
chaleur avec l'extérieur.
2.3.3 La combustion et la détente ( CD – DE )
La combustion est instantanée, la transformation est donc isochore.
Lorsque le piston redescend, la pression diminue et le volume augmente. La transformation est
adiabatique. La détente est le temps moteur.
2.3.4 L'échappement ( EBA )
Lors de l'ouverture de la soupape d'échappement, la pression chute brusquement et retombe à la
pression atmosphérique puis le reste est évacué par la remontée du piston. L'échappement se termine
au PMH, le point de départ du cycle.

Chapitre 2 - 5
2.4 Application : calcul des valeurs en chaque point
Données :
v + V = 1600 cc
v = 200 cc
t admission = 20 °C
t fin combustion = 1800 °C
Demande : Remplir le tableau suivant.
point 1 2 3 4 5
volume (cm³)
température (K)
pression (bar)
1 : début admission 2 : début compression
3 : début combustion 4 : début détente
5 : début échappement
 6
6
 7
7
 8
8
1
/
8
100%