d1-ue3-gonthier-td1-biochimie–27-09-2016

- 1 -
UE3 – Biochimie clinique, nutrition et métabolisme
Pr Gonthier
Date : 26/09/2016 Plage horaire : 10h45-12h45
Promo: D1 2016/2017 Enseignant : Pr Gonthier
Ronéistes :
MARIMOUTOU Alix
SOUPRAYEN RAMAYE Nicolas
TD1 : biochimie clinique
Exercice 1 : Notion d’index glycémique des aliments
Question 1 : Définir la notion d’index glycémique d’un aliment et son importance physiologique.
Question 2 : Présenter le document et son contexte bibliographique.
Question 3 : Quel est l’objectif du travail présenté ?
Question 4
A- Quelle est l’approche expérimentale choisie ?
B- Comment se calcule l’index glycémique d’un aliment ?
Question 5
A- Commenter et expliquer les tableaux 1, 2 du document et la figure 1 ci-dessous.
B- Comparer l’index glycémique des aliments étudiés.
Question 6 : Que peut-on conclure de cette étude ?
Exercice 2 : synthèse « place des protéines en nutrition humaine »
Question 1 : Quelles fonctions biologiques peuvent être attribuées aux acides aminés et protéines ?
Question 2 : Quels types de protéines font partie de la ration alimentaire et quelles sont leurs principales
sources alimentaires ?
Question 3 : Quel est le devenir des protéines alimentaires dans le tube digestif et quels sont les modes de
transport intestinal des molécules absorbés ?
Question 4 : Quelles sont les voies cataboliques et anaboliques associées au métabolisme protéique ?
Question 5 : Quelles interactions sont possibles entre le métabolisme des protéines et le métabolisme des
autres nutriments énergétiques ?
Question 6 : Quelles anomalies peuvent être associées au métabolisme protéique ?

- 2 -
Exercice 1 : Notion d’index glycémique des aliments
Etude de publication intitulée : « The glycemic index of bread and biscuits is markedly reduced by the
addition of a proprietary fiber mixture to the ingredients. »
Question 1 : Définir la notion d’index glycémique d’un aliment et son importance physiologique.
Différence entre index glycémique et la glycémie :
Index glycémique : la quantité de glucides apporté par un aliment qui aura pour conséquence de modifier la
glycémie d’un individu. En gros, c’est mesurer la capacité hyperglycémiante d’un aliment qui module la
glycémie et qui sous-entend indirectement que les glucides ont été absorbé et que le glucose va provoquer
une élévation de la glycémie.
Glycémie : la quantité de glucose qui circule dans l’organisme exprimé en g/L par exemple.
Son importance physiologique est qu’il va être source de glucose qui peut être utilisé comme substrat
énergétique avec l’inconvénient que si l’on consomme des aliments avec des index glycémiques trop élevés,
il y a un risque d’engendrer une insulino-résistance.
Nous avons besoin de savoir si la consommation d’un aliment va aggraver l’état hyperglycémique d’un sujet
diabétique. Le codex alimentaire répertorie l’index glycémique des aliments qui sont sur le marché lors que
les fabricants ont réalisé des études sur l’index glycémique de l’aliment.
Question 2 : Présenter le document et son contexte bibliographique.
Il s’agit d’un article scientifique publié dans un journal indexé intitulé Nutrition, Metabolism &
Cardiovascular Diseases Journal indexé car il a été mis dans une base de donnée, celle-ci s’appelle
ELSEVIER. Ce type de journal est reconnu par des experts. L’article est vérifié par des revieweurs afin de
vérifier la pertinence de l’étude et des moyens utilisés. Le contexte bibliographique se base sur le principe
que les risques cardiovasculaires sont associés à la consommation d’aliments trop sucrés et d’index
glycémique (IG) trop élevé et se pose la question de la stratégie à adopter afin d’éviter l’élévation de la
glycémie. L’une des astuces est de rajouter dans les produits alimentaires des fibres alimentaires qui vont
ralentir l’absorption de glucose et avoir moins de conséquences sur l’élévation brutale de la glycémie qui
pourrait amener à des maladies cardiovasculaires.
Les fibres alimentaires sont des glucides complexes incapables d’être absorbé par les entérocytes. Elles
descendent avec le bol alimentaire au niveau du côlon où elles servent de substrat énergétique pour la
microflore intestinale qui va le dégradé par fermentation.
Les fibres évitent une énorme absorption de glucides et ainsi d’éviter une hyperglycémie postprandiale. Ce
pic glucidique est accompagné d’un hyper-insulinémie et si le pancréas et trop longuement sollicité cela peut
provoquer une défaillance fonctionnelle des cellules ß qui aboutit à une carence en insuline et donc à une
situation diabétique.
Les fibres vont aussi éviter une énorme absorption de lipides et ainsi limiter les complications liées à un
excédent de lipides au niveau sanguin.
Consommer des fibres va permettre d’augmenter la biodisponibilité des minéraux de façon indirecte en
piégeant l’acide phytique, molécule qui piège les minéraux.
ANC dans espèce humaine en fibres : 35g/jr

- 3 -
Quand les fibres alimentaires sont dégradées par les bactéries du côlon, elles génèrent des AG à courtes
chaînes qui sont des substrats énergétique pour la paroi colique qui permet d’avoir un taux de
renouvellement rapide et donc d’éviter le vieillissement de la paroi qui peut développer des polypes et plus
tard le cancer du côlon.
Question 3 : Quel est l’objectif du travail présenté ?
Si l’on ajoute des fibres alimentaires parmi les ingrédients qui permettent de faire du pain et des biscuits on
améliore l’index glycémique de ces aliments.
Question 4
A- Quelle est l’approche expérimentale choisie ?
On réalise la fabrication de deux aliments avec pour chacun un témoin( 1 non enrichi en fibre et 1 enrichi en
fibre). Ces aliments sont fabriqués selon le procédé de panification conventionnelle avec des paramètres
contrôlés par un boulanger (tableau1). Ces aliments ont été transmis au labo afin de réaliser des analyses de
la composition nutritionnelle de ces aliments (tableau 1) et de vérifier si la supplémentation en fibre a bien
fonctionné.
Ils ont utilisé un mélange de 3 types de fibres conventionnées dans l’industrie alimentaire :
- inuline (70%) polymère de fructose dans la chicoré, pissenlit, artichaut = agent de texture des
biscuits
- la gomme guar (20%) polymère de mannose et de galactose retrouvé dans les tubercules (manioc)
- glucomannan (5%) polymère de glucose et de mannose.
En bas du tableau 1, il est inscrit les compositions nutritionnelles de ces aliments en pourcentage et leurs
valeurs énergétiques en Kcal.
Après leur fabrication, les aliments sont exposés à 15 sujets en étude clinique, d’une moyenne d’âge de 25
ans non diabétiques, en situation normo-pondérale, à jeun.
Les 4 aliments et le témoin (75g de glucose) seront testés sur 5 semaines.
Le test permettant de suivre l’expérience est un test glycémique. ON réalise une première mesure à t=0 avant
de donner les aliments. Tous les 15 minutes, pendant 3h, ils mesurent la glycémie et tracent la courbe de la
moyenne des glycémies en fonction du temps.
B- Comment se calcule l’index glycémique d’un aliment ?
En pratique pour calculer l’IG, il faut calculer l’aire sous la courbe du témoin (glucose) et de l’aliment testé.
La valeur de l’IG du produit testé est égale à 𝐴𝑈𝐶 𝑡𝑒𝑠𝑡é
𝐴𝑈𝐶 𝑡é𝑚𝑜𝑖𝑛 x 100

- 4 -
Question 5
A- Commenter et expliquer les tableaux 1, 2 du document et la figure 1 ci-dessous.
Sur la figure 1, le calcul d’aire sous la courbe a permis d’obtenir les aires suivantes : Glucose : 39.575 /
Control bread : 30.096 / Slow bread : 23.975 / Control biscuits : 17.702 / Slow biscuits : 10.457.
Tableau 1 : la supplémentation en fibre a fonctionné, il y a bien une augmentation des pourcentages entre les
aliments de contrôle et les enrichis d’environ un facteur 2. La différence de composition en gras des biscuits
par rapport au pain est toujours présente dans les produits enrichis. La composition en glucide est assez
identique entre le biscuit et le pain.
Rappel : lorsqu’on a 52% de glucides dans la matière sèche = 52gr de glucides sur / 100 gr de matière sèche
Calcul des valeurs énergétiques : (sachant que 1gr de protéines ou de glucides = 4Kcal/ 1gr de lipides =
9Kcal)
- Pain contrôle : (52 g de glucides x 4 Kcal) + (2 g de lipides x9) + (9 g de protéines x4) = 262 Kcal
- Pain enrichi : (48 g de glucides x 4 Kcal) + (2 g de lipides x9) + (9 g de protéines x4) = 246 Kcal
- Biscuit contrôle :(58 g de glucides x 4 Kcal) + (26 g de lipides x9) + (9 g de protéines x4) = 502 Kcal
- Biscuit enrichi : (55 g de glucides x 4 Kcal) + (25 g de lipides x9) + (9 g de protéines x4) = 481 Kcal
L’excédent de gras au niveau des biscuits explique pourquoi ils sont beaucoup plus énergétiques.
B- Comparer l’index glycémique des aliments étudiés.
Les IG des aliments :
- Pain contrôle : 76%
- Pain enrichi : 61%
- Biscuit contrôle : 44,7%
- Biscuit enrichi : 26 %
Question 6 : Que peut-on conclure de cette étude ?
La supplémentation en fibre a bien fonctionné, puisqu’elle a diminué de 21 points du pain témoin par
rapport au pain supplémenté et une diminution de 41 points. On améliore l’Index Glycémique des aliments.
En revanche, même si l’index diminue, la teneur en lipides doit être raisonnable.
Pour contrôler l’index glycémique d’un sujet diabétique, on préfèrera le pain supplémenté ou le pain témoin
aux biscuits pour éviter que le patient consomme 1 à 2 fois plus de lipides.

- 5 -
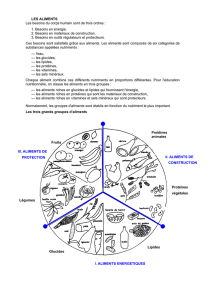
EXERCICE 2 : SYNTHESE « PLACE DES PROTEINES EN NUTRITION
HUMAINE »
Cet exercice est là pour nous permettre d’adopter une démarche. On peut le faire avec les lipides et les
glucides. Lorsque l’on a un substrat énergétique, nous cherchons à savoir sa place dans le domaine de la
nutrition.
Question 1 : Quelles fonctions biologiques peuvent être attribuées aux acides aminés et protéines ?
Rôle substrat énergétique +++ : 1 g de prot. = 4Kcal
Un apport nutritionnel conseillé de 0.8g/kg de poids corporelle/jr, donc un homme de 70 kg doit prendre
env. 70 g de protéines. La ration alimentaire doit être constituée de 15% de protéines pour satisfaire les
besoins énergétiques journaliers de 2000 à 2500 Kcal.
Rôle structural : les protéines jouent une pléiade de fonction possible (enzyme, transporteur,
Hormones, récepteur, facteur de transcription…)
Les AA peuvent être précurseurs de molécules importantes.
Exemple:
- tyrosine précurseur de dopamine qui est le substrat de synthèse de toutes les catécholamines
- le tryptophane précurseur de l’hormone sérotonine,
- histidine qui donne l’histamine qui est un puissant vasodilatateur pour la réaction inflammatoire,
- le glutamate qui donne le GABA,
- la glycine et l’arginine dans la synthèse de la créatine,
- la glycine et le succinyl-CoA pour la synthèse de la porphyrine, de la glycine, glutamate et cystéine
pour la formation du glutathion.
Question 2 : Quels types de protéines font partie de la ration alimentaire et quelles sont leurs principales
sources alimentaires ?
Protéine globulaire : nature sphérique et compact, dite holoprotéine faite exclusivement d’AA et
principalement d’origine végétale.
Protéine fibrillaire : sous forme de fibrille, longue et étroite, souvent des protéines des viandes
d’origine animale. Elles sont souvent des hétéroprotéines associées à un groupement prosthétique
autre que de simples AA. (Exemple : phosphoprotéine comme la caséine du lait, chromoprotéine
comme hémoglobine )
Question 3 : Quel est le devenir des protéines alimentaires dans le tube digestif et quels sont les modes de
transport intestinal des molécules absorbées ?
Le bol alimentaire arrive dans l’estomac, les mouvements gastriques stimulent la production de gastrine qui
elle-même va stimuler la production d’HCl et les pepsinogènes.
Il y a maturation du pepsinogène en pepsine qui commence à dégrader les protéines avec des coupures de
type endopeptidase.
Elles descendent avec le bol au niveau du duodénum et vont croiser les sécrétions qui arrivent du canal
cholédoque qui ramène les sucs pancréatiques. La sécrétion pancréatique a été stimulée par la CCK et la
sécrétine.
Le suc pancréatique sécrété ramène le trypsinogène, proelastase et propeptidase. Le trysinogène va
s’autocliver pour donner la trypsine, lui-même va aider à la maturation des autres enzymes pour donner la
chémotrypsine, l’élastase et des peptidases et donc continue à dégrader les peptides.
 6
6
 7
7
1
/
7
100%