Programme de colle S15

PCSI – Lycée Brizeux 2015 – 2016 1
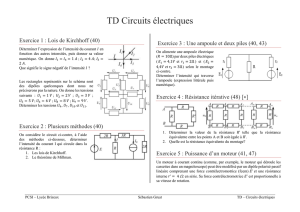
PROGRAMME DE COLLE DU 04/01/16 AU 09/01/16
RÈGLES DE NOMENCLATURE
CHAPITRE 8 : DESCRIPTION DES MOLÉCULES ORGANIQUES
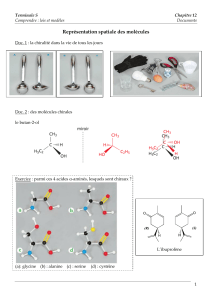
I. Représentations des molécules organiques
1. Formules planes
2. Représentations spatiales
II. Isomérie
1. Définition
2. Isomérie de constitution
3. Stéréoisomérie
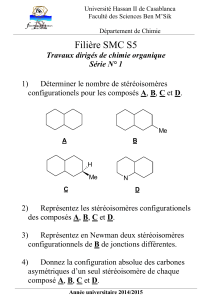
III. Stéréoisomérie de configuration
1. Centre stéréogène, chiralité, configuration
2. Stéréodescripteurs
3. Énantiomérie
4. Diastéréoisomérie
5. Recherche de stéréoisomères de configuration
IV. Stéréoisomérie de conformation
1. Généralités
2. Molécules acycliques
3. Molécules cycliques
CE QU’IL FAUT CONNAÎTRE…
Notions d'isomérie (isomérie de constitution et stéréoisomérie), de centre stéréogène, de chiralité.
Stéréoisomérie de configuration : définitions d'énantiomères, diastéréoisomères, mélange racémique.
Notion de conformation d'une molécule.
Ordre de grandeur de la barrière énergétique conformationnelle.
Activité optique, pouvoir rotatoire, loi de Biot.

PROGRAMME DE COLLE SEMAINE DU 04/01/16 AU 09/01/16
PCSI – Lycée Brizeux 2015 – 2016 2
CE QU'IL FAUT SAVOIR FAIRE…
Maîtriser les différents modes de représentation des molécules organiques : topologique, de Cram, de
Newman, perspective.
Représenter une molécule à partir de son nom, fourni en nomenclature systématique, en tenant compte
de la donnée d'éventuelles informations stéréochimiques, en utilisant un type de représentation donné.
Déterminer la relation d'isomérie entre deux structures.
Utiliser les règles de Cahn, Ingold et Prelog pour attribuer les descripteurs stéréochimiques (R, S, Z, E)
aux centres stéréogènes.
Trouver tous les stéréoisomères d'un composé (et repérer un éventuel composé méso).
Effectuer l'analyse conformationnelle de l'éthane, du butane, et du cyclohexane.
Représenter un dérivé du cyclohexane en conformation chaise à partir de son nom ou de sa représentation
topologique et inversement.
Comparer la stabilité de plusieurs conformations, interpréter la stabilité d'un conformère donné (répulsion
électrostatique, gène stérique).
Pratiquer une démarche expérimentale utilisant l'activité optique d'une espèce chimique.
Relier la valeur du pouvoir rotatoire d'un mélange de stéréoisomères à sa composition.
CHAPITRE 9 : INTRODUCTION À LA RÉACTIVITÉ EN CHIMIE ORGANIQUE
I. Description d’une réaction
1. À l’échelle macroscopique
2. À l’échelle microscopique
II. Réactifs en chimie organique
1. Acides et bases de Brønsted
2. Nucléophiles et électrophiles
III. Réactivité : première approche
1. Contrôle cinétique – contrôle thermodynamique
2. Postulat de Hammond
CE QU’IL FAUT CONNAÎTRE…
Définitions d’une réaction d’addition, d’élimination, de substitution et acido-basique.
Définitions de nucléophile et électrophile.
Définitions de réaction chimiosélective, régiosélective, stéréosélective et stéréospécifique.
Règles du formalisme des flèches de mécanisme.
Postulat de Hammond.

PROGRAMME DE COLLE SEMAINE DU 04/01/16 AU 09/01/16
PCSI – Lycée Brizeux 2015 – 2016 3
CE QU'IL FAUT SAVOIR FAIRE…
Distinguer une équation bilan d’un acte élémentaire.
Reconnaître la nature des réactions (addition, élimination, substitution ou acido-basique).
Écrire les mécanismes réactionnels avec le formalisme des flèches.
Identifier les sites nucléophiles et électrophiles sur une molécule.
Classer un ensemble de nucléophiles par nucléophile croissante.
Utiliser un diagramme d’énergie et le postulat de Hammond pour prévoir l'obtention d'un produit
majoritaire lorsque deux réactions sont en compétition ou pour étudier l'influence d'un paramètre sur la
vitesse d'une réaction.
Prévoir ou analyser la régiosélectivité, la stéréosélectivité et la stéréospécificité éventuelles d'une
transformation simple en chimie organique en utilisant un vocabulaire précis.
1
/
3
100%