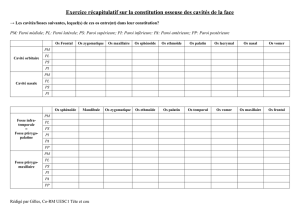
G.P. Questions de cours thermodynamique physique Entropie

G.P. Questions de cours thermodynamique physique
Entropie:
Donner un énoncé du deuxième principe de la thermodynamique.
On considère deux systèmes en contact thermique par une paroi. Les autres parois sont
athermanes. Le système
S1
est formé du système biphasé (eau vapeur+eau liquide) dans les
conditions normales. Le système
S2
est formé du système biphasé (eau glace+eau liquide)
dans les conditions normales. On attend longtemps et la température de la paroi finit par se
stabiliser.
•Décrire alors le système (équilibre thermodynamique, état stationnaire, réversibilité).
•En analysant la situation à l'aide du deuxième principe, démontrer que la chaleur
passe spontanément du chaud vers le froid.
Réponse:
Énoncé du deuxième principe:
Pour tout système fermé, il existe une fonction des variables d'état, extensive, non conservative,
telle que sa variation au cours d'une transformation élémentaire s'écrit :
dS = Séchange Scréé
avec
Séchange=Q
Tfrontière
Scréé 0
si la transformation du système considéré est irréversible ;
Scréé =0
si la transformation du système considéré est idéalement réversible.
Situation envisagée:
Pas d'échanges mécaniques. On ne considère donc que les échanges thermiques.
1) Compartiment
S1
La température reste égale à
T1=100° C
. La température est homogène dans
S1
donc pas de
gradient de température et donc pas de création d'entropie dans
S1
. La proportion eau vapeur-eau
liquide se modifie à cause des échanges thermiques avec l'extérieur. Le système
S1
n'est pas en
équilibre thermodynamique, ni même dans un état stationnaire (puisque sa composition dépend du
temps). La transformation pour
S1
est réversible.
2) Compartiment
S2
La température reste égale à
T2=0°C
. La température est homogène dans
S2
donc pas de
gradient de température et donc pas de création d'entropie dans
S2
. La proportion eau glace-eau
T1
T1
T2
T2

G.P. Questions de cours thermodynamique physique
liquide se modifie à cause des échanges thermiques. Le système
S2
n'est pas en équilibre
thermodynamique, ni même dans un état stationnaire (puisque sa composition dépend du temps). La
transformation pour
S2
est réversible.
3)
La paroi
La température de sa face 1 reste égale à
T1
. La température de sa face 2 reste égale à
T2
. La
paroi est donc soumise à un gradient de température avec création d'entropie. La paroi n'est pas en
équilibre thermodynamique (elle est l'objet d'échanges thermiques), mais son état est stationnaire
(aucun de ses paramètres ne dépend du temps) avec création d'entropie (irréversibilité).
Bilans énergétiques:
A l'instant
t
(pendant
dt
):
1)
S1
reçoit la chaleur élémentaire
Q1
de
la paroi
donc
dU 1= Q1
2)
S2
reçoit la chaleur élémentaire
Q2
de
la paroi
donc
dU 2=Q2
3)
La paroi
reçoit
−Q1
de
S1
et
− Q2
de
S2
donc
dU paroi=− Q1− Q2
. La paroi
est en régime stationnaire donc son énergie interne ne dépend pas du temps:
dU paroi=− Q1− Q2=0
−Q1=Q2
Dans la suite, on pose:
Q2=Q
Q1=−Q
dU
S1
−Q
S2
Q
La paroi
0
Univers=S1S2La paroi
0
Bilans entropiques:
A l'instant
t
(pendant
dt
):
T1
T1
T2
T2
δQδQ

G.P. Questions de cours thermodynamique physique
1)
S1
subit une transformation réversible
dS 1=−Q
T1
S1,échange =−Q
T1
S1,créé=0
2)
S2
subit une transformation réversible
dS 2=Q
T2
S2,échange =Q
T2
S2,créé =0
3)
La paroi
reçoit l'entropie
Q
T1
de
S1
et
− Q
T2
de
S2
donc
Sparoi ,échange=Q
T1
−Q
T2
. La paroi est en régime stationnaire donc son entropie ne dépend pas
du temps:
dS paroi=0
. L'entropie créée dans la paroi vaut donc
Sparoi , créé=− Q
T1
−Q
T2
.
Séchange
Scréation
S
S1
−Q
T1
0
−Q
T1
S2
Q
T2
0
Q
T2
La paroi
Q1
T1
−1
T2
Q1
T2
−1
T1
0
Univers=S1S2La paroi
0
Q1
T2
−1
T1
Q1
T2
−1
T1
Conclusion:
L'entropie créée doit être positive dans une transformation spontanée (donc irréversible):
Q1
T2
−1
T1
0
or ici:
T1T2
donc:
Q0
Le transfert thermique spontané s'effectue donc du chaud vers le froid.
1
/
3
100%