Carbonyles - Département de chimie

© Thierry Ollevier CHM-2000
Chimie organique II
RÉACTIVITÉ DU GROUPEMENT CARBONYLE
6. Acétals
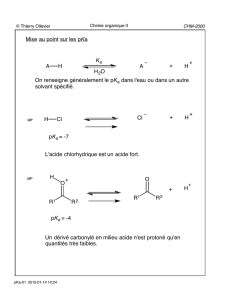
R1H
RO OR
Acétal dérivé d'un aldéhyde Acétal dérivé d'une cétone
R1R2
RO OR
- Les acétals sont formés en milieu acide.
- Les acétals sont stables en milieu basique.
- Les acétals, contrairement aux hémiacétals, sont des composés
isolables (stables).
Caractéristiques
O
R1H
ROH
R1H
RO OR
Aldéhyde Acétal
+
O
R1R2
ROH
R1R2
RO OR
Cétone Acétal
+
2
2
+H2O
+H2O
!
!
carbonyles-21 2016-01-12 15:45

© Thierry Ollevier CHM-2000
Chimie organique II
Mécanisme de formation de l'acétal (en milieu acide !)
O
H
R
O
R1H
ROH
R1H
RO OR
+2+H2O
H+
O
R1H
H+
O
R1H
H
R1H
O O
H
H
O
R1H
H
R1H
O O
H R
R1H
O O
H R
H
R
O
R1H
R
O
R1H
R
O
H
R
R1H
O O
H
R R
R1H
O O
R R
-H2O
+ H+
carbonyles-22 2016-01-12 15:45

© Thierry Ollevier CHM-2000
Chimie organique II
Commentaires
– La formation de l'acétal s'effectue via la formation d'un hémiacétal.
– Un hémiacétal peut être formé en conditions basiques ou acides
mais pour passer de l'hémiacétal à l'acétal il faut se trouver en milieu
acide (car l'acétal ne peut se former qu'en conditions acides).
Illustration
R1H
O O
H R
R1H
O O
H R
H
O
R1H
R
-H2O
R1H
O O
R R
+ H+
Le groupe hydroxyle doit pouvoir être protoné pour pouvoir passer
de l'hémiacétal à l'acétal.
ROH
carbonyles-23 2016-01-12 15:47

© Thierry Ollevier CHM-2000
Chimie organique II
Commentaires (suite)
– La formation de l'acétal s'effectue en présence de quantités
catalytiques d'acide.
– La réaction est globalement équilibrée (toutes les étapes sont
réversibles) mais l'équilibre pourra être déplacé du côté droit en
ajoutant un excès d'alcool et/ou en enlevant l'eau.
O
R1H
ROH
R1H
RO OR
+2+H2O
H+
Illustration
O
R1H
ROH
R1H
RO OR
+2+H2O
H+
- quantité catalytique d'acide
- excès de ROH
- H2O enlevée du milieu réactionnel (par distillation)
- quantité catalytique d'acide
- excès de H2O
- H2O laissée dans le milieu réactionnel
carbonyles-24 2016-01-12 15:48

© Thierry Ollevier CHM-2000
Chimie organique II
Exemples
O
H3CCH3
EtOH
H3CCH3
EtO OEt
+2+H2O
H+
O
MeOH
+2
MeO OMe
H+
+H2O
H+=HCl gazeux (anhydre)
ou
H2SO4 concentré (anhydre)
carbonyles-25 2016-01-12 15:49
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
1
/
20
100%