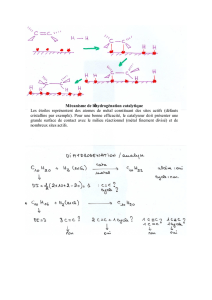
Série de TD N°2 1. Potentiel absolu Toute interface métal/solution

A.H Benchettara TD Méthodes d’analyse électrochimique (M2/FAC304) FC/USTHB 2016/2017
Série de TD N°2
1. Potentiel absolu
Toute interface métal/solution est caractérisée par une double couche électrique qui consiste
en deux feuillet (plans) de charges électriques de signes opposée. L’iterface isolée atteint un
état stationnaire lorsque le phènomène de diffusion qui tend à deplacer les cations métalliques
du réseau cristallin métallique vers la solution est éxactement contecarré par la migration des
cations métalliques en sense opposé, sous l’action du champ électrique.
A une interface métal/solution isolée ( non reliée a une source de courant externe ou à une
autre interface) il se crée une séparation des charges électriques telle que sur la surface du
métal se charge négativement et la surface de la solution se charge positivement.
L’interface est électriquement neutre.
Cette séparation de charges électriques à l’interface métal/solution crée un champ électrique
uniforme perpondiculaire à l’interface.
1.1 Dessiner une telle interface
1.2 Dessiner le vecteur champ électrique crée à cette interface.
1.3 La différence M - S des potentiels du métal et de la solution est appelée potentiel
absolu de l’interface. Peut-on mesurer un potentiel absolu ? Si non, pourquoi ?
2. Potentiel relatif
2.1 Électrode de référence primaire
L’interface :
Ptplatiné /H2(g)(1atm) / HCl(a = 1)
est la référence primaire pour la mesure des potentiels d’électrodes.
2.1.1 Faire le schéma d’une telle électrode.
2.1.2Ecrire son équilibre de demi-réaction et calculer son potentiel d’électrode à 25°C,
sachant que son potentiel d’électrode standard vaut 0V.
2.2 Électrodes de références secondaires
L’électrode de référence primaire étant encombrante et sa mise en place peu commode,
d’autres interfaces ont été sélectionnées pour servir d’électrodes de référence, comme par
exemple :
a) Ag(s) /AgCl(s) / KCl (sat.)

A.H Benchettara TD Méthodes d’analyse électrochimique (M2/FAC304) FC/USTHB 2016/2017
b) Ag(s) /AgCl(s) / NaCl (sat.)
c) Hg(l) /Hg2Cl2(s) / KCl (sat.)
d) Hg(l) /Hg2Cl2(s) / NaCl (sat.)
e) Hg(l) /HgSO4(s) / K2SO4 (sat.)
2.2.1 Calculer les potentiels d’électrodes des interfaces précédentes par rapport à l’électrode
normale à hydrogène, en tenant compte des constantes du tableau suivant.
Couples rédox
Ag+/Ag
Hg22+/2Hg
Hg2+/Hg
E°/V/ENH
0.7996
0.7973
0.851
Sels peu solubles
AgCl
Hg2Cl2
HgSO4
Ks (25°C)
1.77 10-10
1.43 10-18
6.5 10-7
Sels solubles
NaCl
KCl
K2SO4
a±
5.864
2.817
0.133
3. Effet de la double couche électrique sur le transfert électronique à une électrode
polarisée.
3.1 Faire le schéma d’une interface métal/solution reliée au pôle positif d’une source
de courant continu.
3.2 Faire le schéma d’une interface métal/solution reliée à une autre interface
métal/solution de plus bas potentiel absolu.
3.3 Etudier sur les deux cas précédentes l’effet du vecteur champ électrique sur
l’échange d’électrons entre l’oxydant et le réducteur d’un couple Ox/Red.
3.4 A quelle interface la demi-réaction d’oxydation est accélérée ?
3.5 A quelle interface la demi-réaction réduction est retardée ?
3.6 Les deux demi-réactions d’oxydation et de réduction d’un même couple rédox à
une même interface sont elle compétitives ou parallèles ?
1
/
2
100%