Téléchargement (pdf, 406 Ko)

Chers Amis,
Nous nous sommes retrouvés avec plaisir au Novotel Vaugirard pour ces 18e Journées Natio-
nales du Collège de Biochimie, qui nous ont donné l’occasion de constater la bonne santé de
notre association en pleine croissance et de rendre l’hommage qu’elle mérite à sa fondatrice
Danielle Duchassaing à la veille de sa libération … du joug professionnel. Notre présence en
nombre toujours plus important à ces journées et au sein du CNBH est le meilleur témoignage
de la justesse de l’inspiration qu’a eue Danielle lorsqu’elle décida, un jour de 1991, de fédérer
les biochimistes autour d’une volonté commune d’échanger leurs idées et leurs savoir-faire,
sous la double bannière de la Qualité et de la bonne humeur. Son dynamisme et son talent à
mettre en valeur et à développer les potentialités de ses jeunes collègues ont donné au Collège
de Biochimie l’impulsion de départ qui lui assurera une vie longue et fructueuse, c’est en tous
cas le vœu que nous pouvons formuler précisément le jour de sa majorité ! En notre nom à
tous, merci à toi, Danielle.
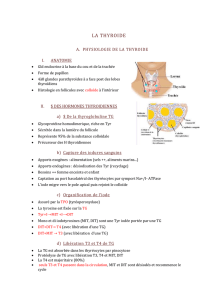
Ces journées consacrèrent la session plénière aux pathologies de la glande thyroïde, dont qua-
tre spécialistes nationaux et internationaux nous ont fait une présentation riche et complète.
Jacques Orgiazzi, Professeur d’Endocrinologie aux Hospices Civils de Lyon et à l’Université
Claude Bernard Lyon-1, a présenté les aspects physiopathologiques de la fonction thyroïdienne
et les mécanismes des principaux dérèglements de cette glande, des effets de la carence en iode
aux aspects génétiques. Puis Rémy Sapin, Catherine Massart et Michèle d’Herbomez, biologis-
tes respectivement aux CHU de Strasbourg, Rennes et Lille ont développé les spécificités ana-
lytiques et les critères de choix des marqueurs biologiques dans les différentes indications cli-
niques, avant que Michèle d’Herbomez ne conclue sur les perspectives d’avenir. Toutes ces
présentations sont disponibles sur Horus, et résumées ci-dessous par les auteurs.
Un grand merci à nos quatre orateurs, et à Michèle d’Herbomez tout particulièrement pour
l’organisation et la modération de cette très intéressante session.
Christine Morin
L’édito de la présidente
Jeudi 22 janvier - session plénière :
Actualités sur les explorations biologiques de la glande thyroïde
TSH, T3 et T4 libres : les indications, les dosages et leurs limites.
Rémi Sapin, CHU de Strasbourg
Le bilan thyroïdien fonctionnel repose sur les dosages de TSH, de T4 et T3 libres (T4L, T3L).
Le dosage de TSH s’est imposé pour le dépistage des dysthyroïdies alors que celui de T4L en
permet la confirmation et la gradation, et que celui de T3L doit être réservé à des indications
plus particulières. L’utilisation de ces dosages dans les circonstances les plus fréquentes, dia-
gnostic et surveillance de l’hypothyroïdie, de l’hyperthyroïdie et de l’hypothyroïdie fruste, a
fait l’objet de recommandations disponibles sur le site de l’HAS pour les deux dernières.
Les dosages immunométriques de TSH de 3ème génération sont suffisamment sensibles. Leur
seul défaut de spécificité reste la reconnaissance de formes moléculaires de faible activité bio-
logique secrétées dans l’insuffisance ante-hypophysaire. Les interférences d’anticorps hétéro-
Compte-rendu des 18èmes Journées
nationales des 22 et 23 janvier 2009
(Novotel Vaugirard - Paris)
Collège National de Biochimie des Hôpitaux
www.cnbh.org
AVRIL
2009
N°13
Côté Bio la lettre du CNBH
Sommaire :
• Edito de la présidente
• Compte-rendu des
18èmes Journées natio-
nales et de l’assem-
blée générale 2008
• Réactovigilance
• Réunions régionales
2009
Comité éditorial :
Françoise Hervochon
Agnès Perrin
Carole Poupon
Michèle Rota
François Thuillier
Marie-Hélène Tournoys

philes et d’anticorps anti-TSH sont exceptionnelles. L’intervalle de référence communé-
ment admis de 0,4 à 4,0 mUI/L peut être adapté en fonction de la technique utilisée.
Les immunodosages de T4L, et plus encore de T3L, sont techniquement délicats. En effet,
la dilution induite par l’addition des réactifs (anticorps et ligand) et la captation d’une cer-
taine quantité d’hormone par l’anticorps ne doivent pas déplacer significativement l’équili-
bre préexistant dans le sérum entre l’hormone libre et liée aux protéines de transport. De
plus, le ligand, compétiteur de l’hormone vis à vis des sites anticorps, ne doit pas interagir
avec les protéines de liaison. Ces exigences sont délicates à satisfaire lorsque la capacité de
fixation des hormones par les protéines vectrices est abaissée (hypoalbuminémie, patients
hospitalisés). Dans ces situations, la plupart des méthodes présentent un biais négatif par
rapport à la dialyse à l’équilibre technique de référence et des discordances inter-méthodes
sont fréquentes. Ce biais est renforcé par l’addition d’albumine dans les réactifs. Les va-
leurs de référence sont très dépendantes de la méthode. Les dosages en deux étapes sem-
blent à l’abri d’une interférence d’anticorps anti-T4 ou T3. Par contre l’interférence de la
dysalbuminémie familiale hyperthyroxinémique (FDH) qui n’est pas systématique peut
être observée avec des dosages en une ou deux étapes.
La bonne connaissance de la technique de dosage et de ses limites peut aider le biologiste à
dialoguer avec le clinicien qui l’interroge sur un bilan discordant. De plus le biologiste ne
doit pas hésiter, si nécessaire, à solliciter ses collègues pour contrôler par une autre métho-
de un résultat suspect (les interférences sont très dépendantes de la méthode) et à se retour-
ner vers le fabricant de réactifs pour caractériser une interférence.
Les marqueurs biologiques de l’autoimmunité thyroïdienne.
Catherine Massart, UF d’Hormonologie, INSERM 0203 Centre d’Investigation
Clinique, CHU de Rennes
Les anticorps (Ac) dirigés contre la thyroglobuline (anti-Tg), la thyroperoxydase (anti-
TPO), le récepteur de la TSH (anti-RTSH) et les hormones thyroïdiennes (anti-T3 et anti-
T4) représentent les marqueurs biologiques circulants des maladies autoimmunes thyroï-
diennes (MTAI). Le dosage des Ac anti-Tg est essentiellement utilisé pour la validation
des résultats de Tg [1]. La présence des Ac anti-T3 et anti-T4 entraîne bien souvent une
interférence dans les immunodosages en une étape des hormones thyroïdiennes libres cir-
culantes. Les Ac anti-TPO et anti-RTSH restent les paramètres principaux qui doivent être
dosés dans l’exploration des MTAI. Le dosage des Ac anti-TPO s’impose notamment pour
le diagnostic des thyroïdites autoimmunes. Les méthodes par hémagglutination passive
devenues obsolètes par leur manque de sensibilité doivent être remplacées par des techni-
ques par immunoanalyse pour la mesure des Ac anti-TPO. A cet effet, il convient 1) de
choisir une méthode utilisant une TPO humaine hautement purifiée ou recombinante 2)
d’éviter les comparaisons de résultats obtenus avec des techniques différentes en l’absence
d’étalon recombinant 3) de citer la limite de détection fonctionnelle (au détriment de la
limite de détection analytique) comme valeur basse du dosage 4) de s’assurer que les va-
leurs de référence aient bien été déterminées chez des sujets de sexe masculin selon les
critères annoncés par le consensus américain [1]. Les Ac anti-RTSH représentent les mar-
queurs sériques de la maladie de Basedow. Ils sont dosés par une technique de seconde
génération (2G) utilisant un RTSH humain fixé sur les parois des tubes et de la TSH bovi-
ne radiomarquée comme traceur. L’apparition de nouvelles trousses de dosage 2G ou de
3ème génération (3G) justifie d’une extrême prudence en pratique de routine. En effet, nous
venons de démontrer dans une étude multicentrique récente qu’il était prématuré d’aban-
donner le dosage 2G isotopique compte-tenu de la variabilité des résultats obtenus avec les
autres techniques 2G ou 3G qu’elles soient manuelles ou automatisées [2].
Références
1. Demeers LM, Spencer CA. Laboratory Medecine Practice Guidelines Laboratory Thyroid
Support for the Diagnosis and Monitoring of Thyroid Disease. Thyroid 2003;13:45-50.
2. Massart C, Sapin R, Gibassier J, Agin A, d’Herbomez M. Inter-method variability in TSH-
receptor antibody measurement : implication for the diagnosis of Graves’ disease and for the
follow-up of Graves’ ophthalmopathy. Clin Chem 2009; 55:183-186.
Côté Bio, n°13
PAGE 2
AG 2008 :
toujours
autant
d’affluence !

Côté Bio, n°13
Les marqueurs sériques des cancers thyroïdiens
Michèle d’Herbomez, CHU de Lille
Les cancers thyroïdiens différenciés sont les cancers endocriniens les plus fréquents. Leur inci-
dence s’est accrue au cours des dernières années sous l’effet d’un dépistage plus actif et d’une
modification des pratiques due à l’apparition de nouveaux outils (échographie, TSH recombinan-
te, méthode d’imagerie performante (TEP) et dosage de thyroglobuline plus sensible). Le pro-
nostic d’ensemble est bon. La prise en charge des cancers doit être adaptée au niveau du risque
du patient. La thyroglobuline (Tg) est un marqueur sensible et spécifique du cancer différencié
de la thyroïde de souche folliculaire. Les dosages de Tg sérique doivent être immunométriques,
calibrés sur le CRM 457 et posséder une sensibilité fonctionnelle < 1 ng/ml. Tout résultat de Tg
sera interprété en fonction du taux de TSH et de la présence ou non d’anticorps anti Tg. qui doi-
vent être recherchés systématiquement (1, 2). En présence d’Ac anti Tg le taux de Tg peut être
minoré avec un dosage immunométrique. Toutes les méthodes sont sensibles à l’interférence des
Ac anti Tg mais dans des proportions variables. Un taux de Tg indétectable en présence d’Ac
anti Tg n’est pas forcément synonyme de rémission. Un taux détectable doit être interprété com-
me étant à minima. La présence d’anticorps hétérophiles peut créer de fausses élévations de Tg.
Elles doivent être suspectées lorsque le résultat est en désaccord avec le reste du bilan.
L’amélioration de la sensibilité fonctionnelle permet d’augmenter la sensibilité du dosage de la
Tg, et d’éviter certains tests de stimulation par la TSH recombinante au prix d’une baisse de la
spécificité. Lorsque le taux de Tg est détectable, la pente évolutive de la Tg a une meilleure va-
leur diagnostique que le taux de Tg lui-même.
Le dosage de Tg dans le liquide de rinçage des aiguilles de ponction de nodules ou ganglions
cervicaux se généralise pour la détection de métastases ganglionnaires. Il montre d’excellentes
performances en complément de la cytologie. Les procédures ne sont pas encore standardisées.
Les cancers médullaires de la thyroïde (CMT) représentent 5 à 8% des cancers thyroïdiens. Ils se
présentent majoritairement dans un contexte sporadique mais dans 25 à 30% des cas héréditaires
(mutation du pronto-oncogène Ret) La prévalence du CMT est faible (proche de 0.4%). Leur
marqueur sensible et spécifique est la calcitonine (CT). Ce peptide de 32 AA a une action hypo-
calcémiante et hypophosphorémiante. La calcitonine est sécrétée par les cellules C. Les dosages
immunométriques avec marqueur radioactif, enzymatique ou luminescent, évaluent la CT matu-
re. Certains sont automatisés. La CT sérique est mesurée en base et/ou sous stimulation par de la
Pentagastrine. Les valeurs de référence varient selon les dosages. Les facteurs à prendre en
compte dans l’interprétation d’un taux de CT en base sont les suivants : le dosage, le sexe, l’âge,
le BMI, et le tabac. La CT sérique peut être augmentée dans un certain nombre de situations au-
tres que le CMT (prévalence supérieure à celle du CMT). Ce sont l’insuffisance rénale, l’hyper-
gastrinémie (prise d’inhibiteurs de la pompe à protons, gastrite atrophique, gastrinome), l’hyper-
calcémie mais aussi en présence d’hyperplasie des cellules C, d’autres tumeurs endocrines
(cancer pulmonaire à petites cellules, carcinoïde bronchique et digestif, phéochromocytome). De
rares cas d’élévations de CT ont été décrits par interférences d’anticorps hétérophiles.
Le temps de doublement de la CT, chez les patients porteurs de CMT et non guéris, est un fac-
teur pronostic indépendant.
Le dosage d’ACE (antigène carcino-embryonnaire) est couplé à celui de CT dans le suivi des
patients opérés de CMT. L’ACE peut être le témoin de dédifférenciation du CMT, donc un mar-
queur de mauvais pronostic.
Références :
• Demers L, Thyroid 2003 ; 1 : 1-123 (consensus américain sur les actes biologiques thyroï-
diens)
• Pacini F , Schlumberger M. Europ J of Endocrinology : 2006 ; 154 :787 (consensus euro-
péen de prise en charge des cancers différenciés de la thyroïde)
• Borson-Chasot F et al. Ann Endocrinol (Paris). 2008 Dec;69(6):472-86 (Version anglaise)
supl de 2007 Déc (version française) Consensus français
• Schlumberger M. Cancers papillaire et folliculaire de la thyroïde. Ann Endocrinol 3007 ;2-
3 :1208.
PAGE 3

Conclusion de la session
Michèle d’Herbomez a terminé cette excellente session avec quelques perspecti-
ves, notamment en matière de surveillance de la femme enceinte. La séance est
levée vers 18h10.
Après cette session très intéressante, la soirée s’est agréablement déroulée à Bobin’O,
alliant cuisine originale et spectacle de cabaret.
Vendredi 26 janvier : Assemblée générale 2008
La présidente Christine Morin ouvre la matinée par quelques mots de bienve-
nue à l’intention des collégiens, avant d’adresser un coup de chapeau à Danielle Du-
chassaing qui fait valoir ses droits à la retraite cette année.
Après avoir porté le Collège sur les fonts baptismaux le 15 octobre 1991 avec
une trentaine de participants de la première heure, Danielle en a assuré la présidence
pendant 6 années et a tracé la mission fédératrice de cette association, avant de trans-
mettre le flambeau en douceur et en toute amitié il y a quelques années, sans pour au-
tant cesser de participer à ses travaux. Elle a même doté le Collège d’un outil perfor-
mant de communication, Horus, sans oublier le webmestre indispensable à la bonne
gestion de ce serveur, Agnès Perrin. Agnès illustre ensuite, à travers un court diapora-
ma, quelques bons moments et les principales étapes de la route commune de Danielle
et du CNBH, avant de lui remettre au nom des collégiens quelques éléments électroni-
ques qui l’aideront à maintenir le contact avec son entourage professionnel. Elle ne
quittera d’ailleurs pas complètement la biologie, puisque le D.U. d’Assurance Qualité
bénéficiera encore de ses enseignements pendant quelques temps.
Danielle Duchassaing remercie Christine et Agnès ainsi que tous les collègues
qui ont participé avec elle au développement du Collège. Elle réaffirme que son but
était la reconnaissance de la Biochimie en tant que discipline à part entière dans l’acti-
vité médicale et la possibilité d’échanges réguliers entre professionnels.
Danielle nous quitte sous les applaudissements de la salle, et la parole est pas-
sée à Jean Louis Beaudeux et Damien Vanhoye (ARC) pour l’atelier de cette mati-
née, consacré aux aspects méthodologiques de la mise en place et de la conduite d’une
étude de recherche clinique.
Aspects méthodologiques de la mise en place et de la conduite d’une étude
de recherche clinique.
Damien VANHOYE1, Jean-Louis BEAUDEUX2
1 Unité de recherche clinique, Hôpital Pitié-Salpêtrière, APHP, Paris
2 Pôle médico-technique, Service de biochimie, Hôpital Charles Foix, APHP, Ivry sur
seine.
La mise en place d’une étude de recherche bioclinique (monocentrique ou multicentri-
que, nationale ou internationale…) est à la fois un projet scientifique et médical pas-
sionnant et un véritable challenge, car la route est souvent longue entre la conception
de la recherche et la publication des résultats. La recherche clinique est une recherche
effectuée chez l’homme malade ou non, dont la finalité est l’amélioration de la santé
humaine et le progrès des techniques de soins dans le respect de la personnalité et de
l’intégrité de chaque individu. Cette définition implique un encadrement réglementaire
très strict de la recherche, et conduit à identifier précisément les différents acteurs : le
promoteur, qui assure la gestion et vérifie la validité du financement, l’investigateur-
coordonnateur, qui supervise l’étude et veille à sa bonne réalisation, et le (les) investi-
gateur(s) des différents centres participants, qui gère(nt) localement le bon déroule-
ment des investigations (cliniques et/ou biologiques). Le promoteur organise la partie
technico-réglementaire du dossier d’étude, en particulier vis-à-vis du comité de protec-
tion des Personnes (CPP), de l’agence française de sécurité sanitaire et des produits de
santé (AFSSAPS) et de la commission nationale Informatique et Libertés (CNIL), dont
les avis sont requis pour la majorité des recherches cliniques. Une fois ces démarches
Côté Bio, n°13
Diaporamas
sur Horus !
PAGE 4

Côté Bio, n°13
réalisées (6 à 12 mois voire plus), le déroulement d’un essai bioclinique suit certaines étapes
incontournables : rédaction des cahiers d’observation et documents techniques spécifiques
(formulaires d’information des participants et des patients, étiquettes d’identification anony-
me des échantillons biologiques, etc.), réunions de préparation des sites d’inclusion, organi-
sation des circuits des échantillons (transmission et phase préanalytique, réalisation des ana-
lyses, cryoconservation de fractions aliquotes…), ouverture des sites, visites de suivi, rap-
ports intermédiaires d’avancement de l’essai, fermeture des sites, analyse statistique, valori-
sation des résultats. La bonne réalisation de ces différentes étapes sera assurée par une éla-
boration structurée du projet, dès ses premières étapes, en veillant constamment à tout défi-
nir, tout prévoir, tout anticiper, afin de limiter au maximum les incertitudes, imprécisions et
décisions immédiates qui pourraient influer sur le cours de l’essai ou sur ses résultats. La
coordination des différents acteurs (cliniciens, biologistes, méthodologiste, biostatisticien,
attaché de recherche clinique, technicien de recherche clinique…) dont les rôles respectifs
doivent avoir été préalablement définis, est essentielle au bon déroulement de l’étude ; elle
garantit la validité des résultats obtenus, et permet leur valorisation scientifique (publication
(s) nationale(s) et/ou internationale(s) communications affichées, rapports d’étude…) assu-
rant la diffusion de l’information obtenue à l’ensemble de la communauté médicale).
Cet exposé très complet et documenté (diaporamas disponibles sur Horus) a généré de nom-
breuses questions de la part de l’auditoire, principalement sur :
− La nécessité d’obtenir une déclaration de « non opposition » des patients pour l’utilisa-
tion des « fonds de tubes » et pour les collections d’échantillons.
− La conduite à adopter lors de tests biologiques effectués à l’étranger ?
− Le CPP : Comité de Protection des Personnes, successeur de l’ancien Comité d’Ethique
(qui doit exister dans chaque établissement hospitalier).
− La participation d’un ARC (attaché de recherche clinique) pour envisager le côté bioé-
thique d’un travail utilisant du matériel humain
− L’attitude à adopter lors de l’arrivée au laboratoire de prélèvements dans le cadre d’un
essai clinique non connu (essayer de contacter un responsable pour trouver un accord en
termes de temps, de finances…)
− L’accompagnement d’un méthodologiste : dans chaque CHU il existe une délégation à
recherche clinique à laquelle il est possible de faire appel.
Pierre ABERER présente la synthèse des réponses au questionnaire « biologie et essais
cliniques. Etat des lieux », auquel 87 hôpitaux ont répondu.
81 réponses ont été exploitables (6 centres hospitaliers ne faisant pas d’essais cliniques).
50% déclarent avoir eu connaissance de la réalisation de 0 à 5 essais par an dans leur éta-
blissement. 78 établissements ont été contactés par le promoteur pour une présentation de
l’essai clinique.
70 CH jugent « utile » cette présentation en termes d’intérêt sur les objectifs, la place du
laboratoire, l’aspect financier et l’existence d’un co-investigateur biologique.
Les questions soulevées par la présentation :
- Existe-t-il une possibilité de reversement à une association de FMC lorsqu’il existe
une contractualisation directe avec le promoteur ?
- Quelle démarche entreprendre auprès du directeur financier pour percevoir une sub-
vention dans le cadre de ces Etudes Cliniques ?
P. Aberer propose la constitution d’un groupe de travail, et fait appel aux bonnes volontés
pour éditer : un guide de recommandations, une convention type, un barème de facturation
PAGE 5
Diaporamas
sur Horus !
 6
6
 7
7
 8
8
1
/
8
100%