Acide lactique

ACIDE LACTIQUE.
1. GENERALITES.
L'acide lactique résulte de la transformation enzymatique du ………………………..
O
Formule semi-développée : CH3 – CH - C
OH OH
C’est un composé bifonctionnel, comportant :
- une fonction acide carboxylique caractérisée par le groupe carboxyle …………… ;
- une fonction alcool secondaire caractérisée par le groupe hydroxyle ……….……...
Remarques :
La formule générale d'un acide carboxylique est ……………………
- Si la chaîne n'est pas ramifiée, le nom dérive de celui de l'alcane ayant le même squelette carboné en
remplaçant le « e » final par le suffixe « oïque », le nom étant précédé du mot acide.
- Si la chaîne est ramifiée, la chaîne principale est la chaîne la plus longue contenant le groupe fonctionnel.
La chaîne est toujours numérotée à partir du C fonctionnel qui porte donc l'indice 1.
Exemples :
………………………………………
O
CH3 - CH - CH2 - C
CH3 OH
acide butanoïque
........................................................
Dans la nomenclature officielle, l’acide lactique est l’acide …………………………………………….
2. PROPRIETES DES ACIDES CARBOXYLIQUES.
2.1. Notion d'acide.
Un acide est une espèce capable de ………………… un proton H+.
Exemples :
- acide chlorhydrique : HCl ………………………
- acide lactique : CH3 - CH - C – OH ........................................................................
OH O
acide lactique ion …………………..

0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
Remarque : Une base est une espèce capable de …………………. un proton H+.
Exemple de l’ion HO – (présent dans la ……………) : HO – + H+ …………..
2.2. Dissolution d'un acide dans l'eau.
Quand on dissout un acide dans l'eau, il libère un ……………. qui est capté par une molécule d'eau : on
obtient un ion hydronium ………….. H+ + H2O …………….
- Dissolution de l'acide chlorhydrique : HCl + H2O …………….
Cette dissolution est totale : on dit que l'acide chlorhydrique est un acide ……………..
- Dissolution de l'acide lactique :
CH3 - CH - C – OH + H2O ……………………………………………………..
OH O
Cette dissolution est partielle : la double flèche indique le caractère limité de cette réaction. En fait, seule une
partie des molécules d'acide lactique réagissent avec l'eau : on dit que l'acide lactique est un acide ……………...
- Cas général d'un acide carboxylique :
R – C – OH + H2O H3O+ + ................................
O
acide carboxylique ion ……………………..
Tous les acides carboxyliques sont des acides ………………...
3 PH D'UNE SOLUTION.
3.1. Rappels.
Le pH est une grandeur comprise entre 0 et ………. qui s'exprime sans unité.
On le mesure soit avec du papier pH, soit avec un pH-mètre (voir TP).
A 25°C, une solution aqueuse est :
acide si son pH ……... 7
neutre si son pH ……. 7 (comme l'eau pure)
basique si son pH …... 7
solutions …………… solutions ……………….
pH
de + en + …………. de + en + ………………
solutions ……..……

0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
0 1 10-1 10-2 10-3 10-4 10-5 10-6 10-7 10-8 10-910-1010-1110-1210-1310-14
[H3O+]
(mol . L-1)
Plus le pH est faible, plus la solution est ………….., donc si on dilue une solution acide, son pH ……………...
Plus le pH est élevé, plus la solution est …………..., donc si on dilue une solution basique, son pH …………...
3.2. Définition.
Le pH d'une solution aqueuse est lié à la concentration des ions H3O+ présents dans cette solution par la relation :
[H3O+] = ……… avec [H3O+] exprimée en …………….
Par exemple :
- si pH = 2 alors [H3O+] = …………. mol . L-1
- si pH = 2,9 alors [H3O+] = ……….. = …………………. mol . L-1
Plus [H3O+] est grande, plus le pH est ……………. et plus la solution est ………………..
4. DOSAGE DE L'ACIDE LACTIQUE.
Un lait frais contient très peu d'acide lactique (son pH est voisin de 7). Cependant, en présence de certaines
bactéries, une partie du ………………. se transforme en acide lactique (fermentation lactique).
Ainsi, de mauvaises conditions de conservation augmentent l'acidité du lait conduisant à la modification du goût,
de l'apparence ou de la valeur nutritionnelle du lait.
L'acidité du lait s'exprime conventionnellement en degré Dornic (noté °D) :
1 °D équivaut à 0,1 g . L-1 d'acide lactique.
- Un lait est considéré comme frais si son acidité est inférieure à 18 °D.
- Il caille par simple chauffage si son acidité est supérieure à 40 °D (fabrication du fromage).
- Il caille à la température ambiante si son acidité est supérieure à 60 °D.
La détermination de la quantité d'acide lactique dans le lait est donc une bonne indication de sa fraîcheur : on
l’obtient à partir d'un dosage par une solution titrée de soude.
4.1. Réaction du dosage.
Les ions HO - de la soude réagissent avec l'acide lactique suivant la réaction totale :
CH3 - CH - C – OH + HO - H2O + ....................................................
OH O
Remarque : Les ions Na+ de la soude ne participent pas à la réaction (ions ………………………..).
pH

4.2. Principe du dosage.
- On veut déterminer la concentration molaire CA de l'acide lactique dans le lait.
Pour cela, on prélève un volume VA de lait.
La quantité d'acide lactique initialement présente est donc : nA = …………………...
On ajoute quelques gouttes de phénolphtaléine : la solution étant acide, elle reste incolore.
- On verse progressivement dans le lait une solution titrée de soude de concentration molaire CB :
- Si n(HO -) < nA , l'acide lactique est en …….… : la solution reste ……….. et la phénolphtaléine ………….…...
- Si (HO -) > nA , les ions HO - sont en ……..… : la solution devient ……….….. et la phénolphtaléine ……..…...
Donc, pour une certaine quantité de soude, le pH varie brusquement.
La solution, qui au départ est acide, devient brusquement basique, donc la phénolphtaléine devient rose : le
changement de couleur se fait à la goutte près, on est alors à l'équivalence.
Si on note VB le volume de soude versé à l'équivalence, la quantité d'ions HO - versée à l'équivalence est
nB = …………………..
- A l'équivalence, les réactifs de la réaction du dosage sont dans les proportions stoechiométriques, c'est-à-dire
que la quantité nB d'ions HO - versée est ……………….. à la quantité nA d'acide lactique initialement présente :
nA = ……… donc CA
VA = ……………….
On connaît CB (solution titrée), on mesure les volumes VA et VB, on en déduit CA : CA = ……………
5. EXERCICES.
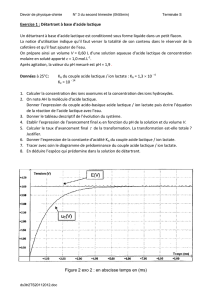
Exercice 1
On dissout 300 mg d'acide lactique dans de l'eau distillée pour obtenir V = 50 mL de solution.
On mesure le pH de la solution à l'aide d'un pH-mètre : on obtient pH = 2,6.
1. Calculer la concentration massique puis la concentration molaire de cette solution.
2. Calculer la concentration des ions H3O+ dans la solution.
3. En déduire le pourcentage de molécules dissociées lors de la dissolution.
Exercice 2
On dose 10 mL de lait par une solution de soude de concentration molaire C = 0;02 mol . L-1 en présence de
phénolphtaléine. Il faut verser 8,5 mL de solution d'hydroxyde de sodium pour qu'une coloration rose apparaisse.
1. Écrire l'équation chimique de la réaction du dosage.
2. Déterminer la concentration molaire en acide lactique, puis le degré Dornic du lait. Le lait est-il frais ?
3. On répète la même opération quelques jours plus tard sur un autre échantillon de 10 mL du même lait : il faut
alors verser 24 mL de solution d'hydroxyde de sodium.
Calculer le nouveau degré Dornic du lait. Que peut-on en conclure ?

ACIDE LACTIQUE.
1. GENERALITES.
L'acide lactique résulte de la transformation enzymatique du lactose.
O
Formule semi-développée : CH3 - CH - C
OH OH
C’est un composé bifonctionnel, comportant :
- une fonction acide carboxylique caractérisée par le groupe carboxyle - COOH ;
- une fonction alcool secondaire caractérisée par le groupe hydroxyle –OH.
Remarques : O
La formule générale d'un acide carboxylique est R – C
OH
- Si la chaîne n'est pas ramifiée, le nom dérive de celui de l'alcane ayant le même squelette carboné en
remplaçant le « e » final par le suffixe « oïque », le nom étant précédé du mot acide.
- Si la chaîne est ramifiée, la chaîne principale est la chaîne la plus longue contenant le groupe fonctionnel.
La chaîne est toujours numérotée à partir du C fonctionnel qui porte donc l'indice 1.
Exemples :
………………………………………
O
CH3 - CH - CH2 - C
CH3 OH
acide butanoïque
........................................................
Dans la nomenclature officielle, l’acide lactique est l’acide 2-hydroxypropanoïque.
2. PROPRIETES DES ACIDES CARBOXYLIQUES.
2.1. Notion d'acide.
Un acide est une espèce capable de céder un proton H+.
Exemples :
- acide chlorhydrique : HCl H+ + Cl –
- acide lactique : CH3 - CH - C – OH H+ + CH3 - CH - C – O -
OH O OH O
acide lactique ion lactate
 6
6
 7
7
 8
8
1
/
8
100%