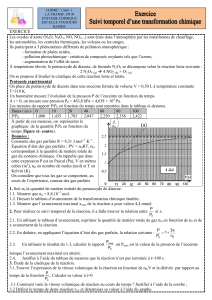
Suivi temporel d`une transformation chimique par pressiométrie

Suivi cinétique pression Page 1 sur 2
Suivi temporel d’une transformation chimique par
pressiométrie
Introduction
I)
L
OI DES GAZ PARFAITS
Rappeler l’équation des gaz parfaits .Préciser les unités à utiliser.
II)
L
A REACTION CHIMIQUE
:
UN EXEMPLE DE SUIVI TEMPOREL
• On fait réagir le métal magnésium et l’acide chlorhydrique.
• Ecrire l’équation de la réaction chimique (réactifs donnent produits)
III)
P
ROTOCOLE EXPERIMENTAL
1)
Le montage (légender le montage ci-desssous)
2)
Descriptif
• On introduit un volume V d’acide chlorhydrique dans le flacon (voir schéma). Puis on ajoute une masse m de métal
magnésium..
• La pression initiale dans le flacon est P
0
.
• On a déclenché le chronomètre dés que le magnésium est mis en contact avec l’acide chlorhydrique.
• La température θ est maintenue constante, le volume occupé par le gaz (V
gaz
) est connu et demeure lui aussi
constant.
• Le pressiomètre affiche la pression, laquelle sera relevée pendant 20 min environ.
IV)
T
ABLEAU D
’
AVANCEMENT DE LA REACTION CHIMIQUE
équation de la réaction Mg(s) + 2 H
+
(aq) → H
2
(g) + Mg
2+
(aq)
état du système
avancement
Nombre de moles
état initial 0 n
I
(Mg) excès 0 0
état intermédiaire x(t)
• Exprimer x(t) en fonction de n (H
2
)

Suivi cinétique pression Page 2 sur 2
V)
R
ELATION ENTRE L
’
AVANCEMENT ET LA PRESSION MESUREE
1) Quel est le gaz présent avant la réaction chimique ?
2) Quelle est la pression avant la réaction chimique ?
3) Quelle est la composition du gaz quand la réaction a commencé ?
Loi de Dalton :
La pression exercée par un mélange de deux gaz est égale à la somme des pressions
individuelles des deux gaz.
4) En déduire la pression exercée par le gaz dihydrogène (p(H
2
) (t) (t) )à l’instant t
5) Exprimer p(H
2
) (t) en utilisant l’équation des gaz parfaits.
6) En déduire une expression de x(t) en fonction de p(H
2
) (t)
7) Calculer la dérivée de l’avancement x(t) .
VI)
E
XEMPLE
1
/
2
100%